XiaoMi-AI文件搜索系统
World File Search System甲基化状态启动子MGMT确定基于神经胶质MRI的深度学习方法
MGMT启动子甲基化是一个表观遗传事件。 表观遗传事件在功能上是相关的,但不涉及核苷酸序列的变化。 因此,虽然MGMT启动子甲基是一个重要的预后标记,但它并不能定义胶质瘤的分离子集。 MGMT是一种DNA修复酶,可保护鼻孔和gliomacellsalsymacellsylatingchemotherapeen剂。 MGMT启动子的甲基化是表观遗传沉默的一个例子,导致MGMT酶功能损失及其对神经胶质瘤细胞的保护作用。 MGMT启动子甲基化在用替莫唑胺(TMZ)治疗的患者中产生的表面益处。。MGMT启动子甲基化是一个表观遗传事件。表观遗传事件在功能上是相关的,但不涉及核苷酸序列的变化。因此,虽然MGMT启动子甲基是一个重要的预后标记,但它并不能定义胶质瘤的分离子集。MGMT是一种DNA修复酶,可保护鼻孔和gliomacellsalsymacellsylatingchemotherapeen剂。MGMT启动子的甲基化是表观遗传沉默的一个例子,导致MGMT酶功能损失及其对神经胶质瘤细胞的保护作用。MGMT启动子甲基化在用替莫唑胺(TMZ)治疗的患者中产生的表面益处。1随后的Stupp等人2的工作表明,在接受放射线和替莫唑胺的患者中,MGMT促进甲基化改善了中值的中位数生存期(相比之下,甲基化的中位数(21.7 vs 12.7个月)。2
Brandon Lao,Alexey Tomilov博士,Michael Kent DVM,Gino A. Cortopassi Ph.D. 2024年11月 - 关注麻醉CE:文章/博客:
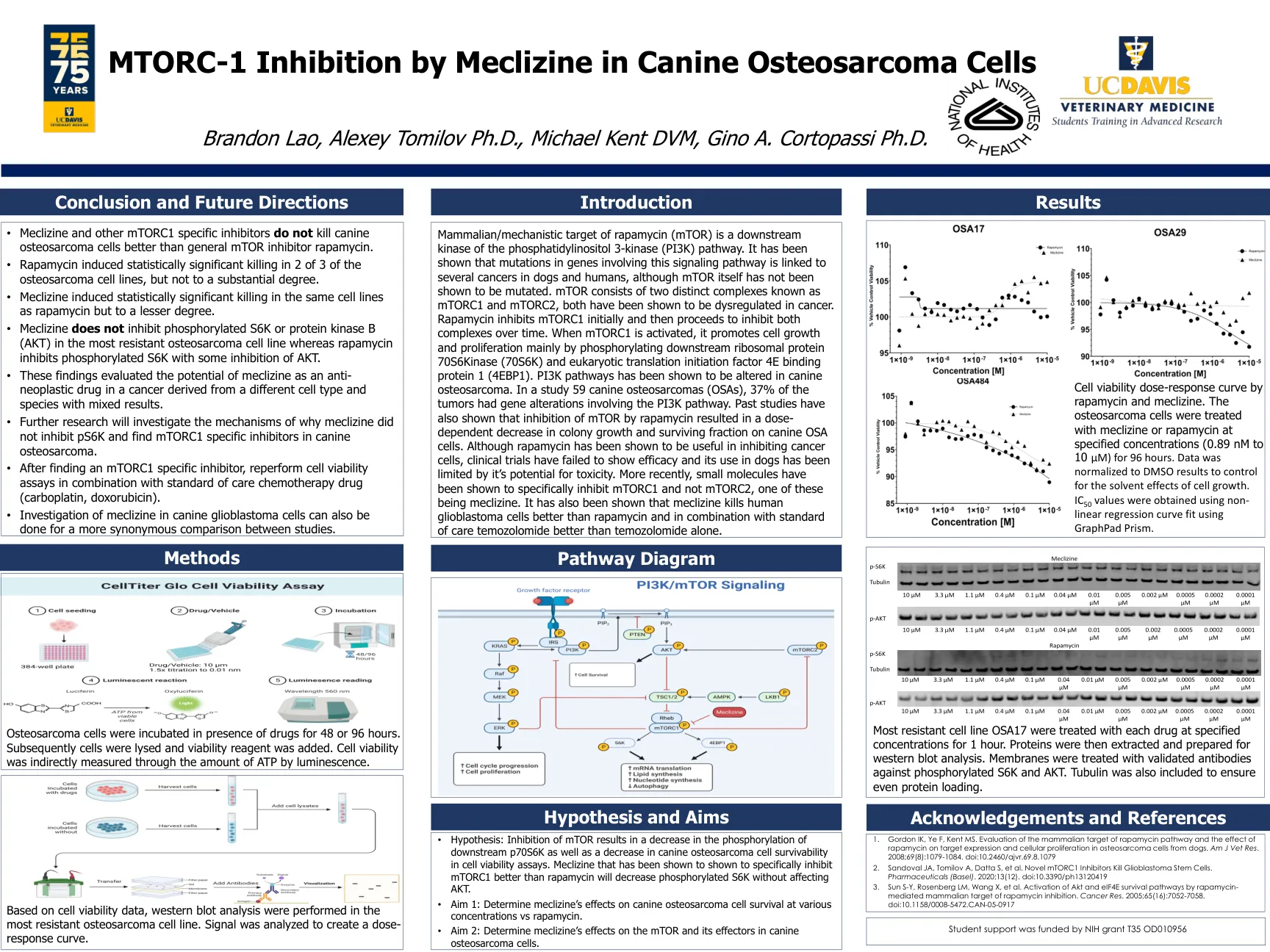
雷帕霉素(MTOR)的哺乳动物/机械靶标是磷脂酰肌醇3-激酶(PI3K)途径的下游激酶。已经表明,涉及该信号通路的基因中的突变与狗和人类的几种癌症有关,尽管MTOR本身尚未被证明是突变的。mTOR由两种称为mTORC1和mTORC2的不同复合物组成,两者均在癌症中均失调。雷帕霉素最初抑制mTORC1,然后随着时间的推移抑制这两个复合物。激活MTORC1时,它主要通过磷酸化下游核糖体蛋白70s6kinase(70S6K)和真核翻译因子4E结合蛋白1(4EBP1)来促进细胞生长和增殖。PI3K途径已显示在犬骨肉瘤中已改变。 在一项研究59犬骨肉瘤(OSA)中,有37%的肿瘤具有涉及PI3K途径的基因改变。 过去的研究还表明,雷帕霉素对MTOR的抑制作用导致菌落生长的剂量降低,并在犬OSA细胞上存活。 尽管雷帕霉素已被证明可用于抑制癌细胞,但临床试验未能显示出疗效,并且其在狗中的使用受到其毒性潜力的限制。 最近,小分子已被证明特异性抑制MTORC1,而不是MTORC2,其中一种是麦芽钛矿。 也已经表明,麦芽己是比雷帕霉素更好地杀死人胶质母细胞瘤细胞,并且与单独的替莫唑胺相比,与护理标准的替莫唑胺相结合。PI3K途径已显示在犬骨肉瘤中已改变。在一项研究59犬骨肉瘤(OSA)中,有37%的肿瘤具有涉及PI3K途径的基因改变。过去的研究还表明,雷帕霉素对MTOR的抑制作用导致菌落生长的剂量降低,并在犬OSA细胞上存活。尽管雷帕霉素已被证明可用于抑制癌细胞,但临床试验未能显示出疗效,并且其在狗中的使用受到其毒性潜力的限制。最近,小分子已被证明特异性抑制MTORC1,而不是MTORC2,其中一种是麦芽钛矿。也已经表明,麦芽己是比雷帕霉素更好地杀死人胶质母细胞瘤细胞,并且与单独的替莫唑胺相比,与护理标准的替莫唑胺相结合。
“重新利用 FDA 批准的抑制线粒体功能的药物来针对胶质瘤干细胞。”
多形性胶质母细胞瘤 (GBM) 肿瘤在各种分化的 GBM 细胞 (d-GC) 中含有少量胶质瘤干细胞样细胞 (GSC)。GSC 会导致肿瘤复发,并对替莫唑胺 (TMZ) 产生耐药性,替莫唑胺是 GBM 化疗的标准治疗 (SoC)。为了研究 GSC 特异性线粒体功能与 SoC 耐药性之间的潜在联系,对两种患者来源的 GSC 系的线粒体代谢差异进行了评估。在这两种系中,与 d-GC 相比,GSC 的线粒体含量和功能明显较低。在体外,标准线粒体特异性抑制剂寡霉素 A、抗霉素 A 和鱼藤酮选择性抑制 GSC 增殖的程度比 d-GC 和人类原代星形胶质细胞更大。这些发现表明,线粒体抑制可以成为 GBM 中一种潜在的 GSC 靶向治疗策略,同时将脱靶毒性降至最低。从机制上讲,标准线粒体抑制剂通过诱导细胞凋亡或自噬途径引发 GSC 选择性细胞毒性作用。我们在 3 种安全的 FDA 批准药物(三氟拉嗪、米托蒽醌和吡维胺帕莫酸盐)存在下测试了 GSC 增殖情况,这些药物也都是已知的线粒体靶向药物。SoC GBM 治疗药物 TMZ 不会在胶质瘤干细胞中引发细胞毒性,即使在 100 μM 浓度下也是如此。相比之下,三氟拉嗪
2020; 16(14): 2595-2611. doi: 10.7150/ijbs.45886 研究论文 西达本胺使非小细胞肺癌对克唑替尼的敏感性增加 12 倍
引言:克唑替尼是一种靶向c-MET/ALK/ROS1的激酶抑制剂,是治疗ALK突变非小细胞肺癌(NSCLC)的一线药物。尽管35-72%的NSCLC中c-MET经常过表达,但大多数NSCLC主要对克唑替尼治疗有耐药性。方法:使用一组NSCLC细胞系在体外和体内测试西达本胺对原发性克唑替尼耐药的影响。通过一系列分子生物学检测系统地研究了西达本胺的协同作用与c-MET表达和RNA甲基化之间的关系。结果:我们首次发现西达本胺可以在一组无ALK突变的NSCLC细胞系中增强克唑替尼的作用,尤其是那些c-MET表达水平高的细胞系。值得注意的是,在不含肝细胞生长因子 (HGF;一种 c-MET 配体) 的无血清培养基中培养的 NSCLC 细胞对克唑替尼的敏感性,西达本胺无法增加该细胞对克唑替尼的敏感性。相反,在无血清/无 HGF 的培养基中添加 HGF 可以恢复西达本胺的协同作用。此外,用 c-MET 抗体治疗或 siRNA 敲低 c-MET 表达也可以消除西达本胺的协同作用。虽然 c-MET 表达低或无表达的细胞主要对西达本胺-克唑替尼联合治疗具有抗性,但强制 c-MET 过表达可以增加这些细胞对西达本胺-克唑替尼联合治疗的敏感性。此外,西达本胺可以通过下调 METTL3 和 WTAP 表达来抑制 mRNA N6-甲基腺苷 (m6A) 修饰,从而降低 c-MET 表达。西达本胺联合克唑替尼治疗可显著抑制c-MET下游分子的活性。结论:西达本胺通过降低c-MET mRNA的m6A甲基化水平,下调c-MET的表达,从而以c-MET/HGF依赖的方式增加NSCLC细胞对克唑替尼的敏感性。
南非耐药结核病成人患者的利奈唑胺群体药代动力学
摘要 利奈唑胺广泛用于治疗耐药结核病 (DR-TB),但治疗指数较窄。为了指导剂量优化,我们旨在描述南非 DR-TB 患者的利奈唑胺群体药代动力学特征,并探索包括 HIV 合并感染在内的协变量对药物暴露的影响。数据来自一项随机对照试验和一项观察性队列研究中的药代动力学子研究,这两项研究均招募了患有耐药性肺结核的成年人。参与者接受了密集和稀疏血浆采样。我们使用非线性混合效应模型分析了利奈唑胺浓度数据,并进行模拟以估计推定的疗效和毒性目标的实现情况。共有 124 名参与者提供了 444 份血浆样本;116 名参与者的标准日剂量为 600 毫克,而 19 名参与者因不良事件将剂量减至 300 毫克。 61 名参与者为女性,71 名 HIV 阳性,平均体重为 56 公斤(四分位距 [IQR],50 至 63)。在最终模型中,清除率和中心容积的典型值分别为 3.57 升/小时和 40.2 升。HIV 合并感染对利奈唑胺暴露没有显著影响。模拟显示,600 mg 剂量达到疗效目标(在 0.5 mg/L 的 MIC 水平下,游离、未结合药物部分的浓度-时间曲线下面积 [ f AU C 0 24 h = 最低抑菌浓度 ½ MIC . 119)的概率为 96%,但超过安全目标(谷值 h 24 h . 2mg = 升Þ)的概率为 56%。300 mg 剂量未达到足够的疗效暴露。我们的模型描述了南非 DR-TB 患者的利奈唑胺群体药代动力学,并支持在安全监测下每天服用 600 mg 剂量。
引用本文:Unal C、Alan Selcuk N、Biricik FS、Alan O、Ordu C、Selvi O 等。评估镥-177 DOTATATE 肽 R 的临床影响
神经内分泌肿瘤 (NET) 源自弥漫性神经内分泌细胞,可出现在身体的任何部位。[1-3] 虽然许多 NET 无症状且无功能,通常是在尸检过程中偶然发现的,[4] 但 NET(主要源自胰腺和胃肠道系统)的发病率和患病率一直在上升。同时,随着新治疗方式的出现,患者的预期寿命显着增加。[5-9] 对于转移性或复发性疾病患者,多学科治疗方法必不可少。根据疾病的程度,治疗方案包括肽受体放射性核素治疗 (PRRT)、依维莫司、生长抑素类似物和靶向治疗以及基于替莫唑胺的化疗方案,最终决定取决于临床医生的判断。[10]
重症监护静脉注射专着
Alfentanil可从SPC www.emc.medicines.org.uk获得全部详细信息,或使用可在Intranet剂量维护上获得的可注射医学指南:每小时0.5-2.5mg每小时静脉输液式插入路线仅准备5mg/10mg ampoules 5mg/10ml Ampoules将25mg Alfentanil降落为50ml Sysys a 50ml Syring。纯溶液的浓度为1mg/2ml。Administration Comment on Trust's SMARTPUMPS Storage / Stability After reconstitution, use immediately Flushing Flush with sodium chloride 0.9% or glucose 5% Other Information Compatible infusions: Acetycysteine, adrenaline, aminophylline, amiodarone (if both in glucose 5%), aprotinin, atracurium, bivalirudin, cisatracurium, clonidine,葡萄胺,多巴胺,多巴胺,多巴胺,多甲胺,埃斯莫洛尔等,芬太尼,芬太尼,速气素,肝素钠,胰岛素,labetalol,linezolid咪唑胺,甲唑胺,硫酸吗啡硫酸盐,硫酸盐,甲肾上腺素,去丙酸酯,丙酸酯,丙二醇,丙二醇,丙二醇
高级别胶质瘤的潜在新治疗方法
摘要:已证实重新利用的药物在体外可成功治疗高级别胶质瘤;然而,由于体外模型不能真实反映临床情况,因此其临床成功率有限。在本研究中,我们使用了两种不同的患者来源的肿瘤碎片(肿瘤核心 (TC) 和肿瘤边缘 (TM))来生成异质性、临床相关的体外模型,以评估重新利用的药物(伊立替康、匹伐他汀、双硫仑、葡萄糖酸铜、卡托普利、塞来昔布、伊曲康唑和噻氯匹定)组合是否可以成功治疗高级别胶质瘤,每种药物都针对不同的生长促进途径。为了确保我们数据的临床相关性,我们使用了来自 11 位不同患者的 TC 和 TM 样本。我们的数据表明,在 100 µ m 或更低的浓度下,所有药物组合的 LogIC 50 值均低于替莫唑胺,其中一种组合在治疗 6 天后使 5 个 TM 样本的细胞存活率降至 4% 以下,几乎根除了癌症。替莫唑胺在 14 天的测定中无法阻止肿瘤生长,而组合 1 可以阻止肿瘤生长,组合 2、3 和 4 在较高剂量下减缓了肿瘤生长。为了验证细胞毒性数据,我们使用了两种不同的测定方法,终点 MTT 和实时 IncuCyte 寿命分析,以评估组合对患者 3 的 TC 片段的细胞毒性,两种测定中的细胞存活率相当。局部施用针对高级别胶质瘤不同生长促进途径的再利用药物组合,有可能转化为临床治疗高级别胶质瘤的新型治疗策略。
ECM-VB1噬菌体的隔离和表征...
通过椎间盘扩散法确定了大肠杆菌分离株对不同抗生素的敏感性,如表1所示。数据表明,大肠杆菌分离株中有7.7%(5/65)对前苯甲苯具有抗性,分离株中有9.2%(6/65)对硝基氟耐药有抗性,分离株的21.5%(14/65)是对氯苯二甲酸的耐药性,47.7.7%(31/65)的抗性抗性(31/65)。 53.8%(35/65)的分离株对哌拉西林 - tazobactam有抵抗力,分离株的67.6%(44/65)对三甲氧苄啶甲基甲氧唑抗性,分离株的70.7%(46/65)是脱离了81.5%(53/65 ep)的分离株(46/65)。分离株的95.4%(62/65)是头孢唑啉和头孢曲松抗性,97%(63/65)的分离株对环丙沙星具有抗性,最后,头孢二胺,阿莫替辛和阿莫克西林 - 克拉氨酸盐和阿莫克西林 - 克氨酸酯均未对100%(65/65/65/65/65)的有效有效。所有65个分离株均为MDR。