XiaoMi-AI文件搜索系统
World File Search Systemnd NPS项目联系人目录
PTMAPP Web增强项目Red River Basin River Watch&Dreams计划Red River Basin Hydoctitioning Project
cm 1637/25 1联系人:coreper.2@consilium.europa.eu ...
理事会决定与喀麦隆共和国终止自愿合伙协议(VPA)在森林执法,治理和木材产品协议中的贸易,原则上要求欧洲议会批准的欧洲议会同意,第1部分,12.02.2025
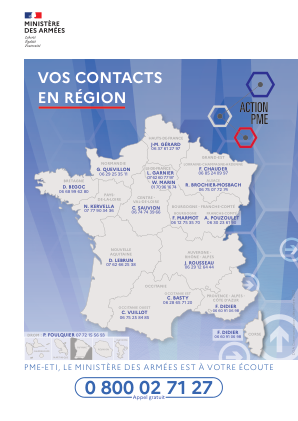
您在该地区的联系人 - 武装部队部
中心 - 瓦勒德卢瓦尔省 C. SAUVION 06 74 74 39 66 BURGUGNE F. MARMOT 06 12 75 35 70
媒体联系人 - 国防合同管理局
使命:我们是国防部及其合作伙伴的独立耳目,通过确保及时交付优质产品并提供支持可负担性和准备就绪性的相关采购见解来提高作战人员的杀伤力。愿景:一支值得信赖的专业团队,在整个采购生命周期内为我们的作战人员提供价值。价值观:诚信 - 始终致力于最高的道德和道德行为标准。服务 - 为我们国家的利益而工作,将专业责任置于个人利益之上。卓越 - 致力于在我们所做的每一件事上都表现出色。机构数据* 文职人员数量:10,339 军事人员数量:567 有效合同数量:226,230 合同总金额:3.92 万亿美元 承诺金额:2.208 万亿美元 承包商付款授权:每个工作日(250 天)8.813 亿美元* 2QFY22 数据
cm 1035/25 1联系人:life.coordination@consilium.europa.eu ...
Art 7 bis,我们认为这种新程序很难阅读,详尽无遗(几乎4页),并且我们有问题可以理解实用性。因此,我们将要求总统审查写作,并为成员国提供流程图或计划,以帮助我们了解一眼的过程。Art 7 Ter,我们想听到1.是否有一个特殊的原因,禁止引入植物生殖材料的营销,而不是禁止种植1类植物的植物?我们想以书面形式获得洞察力(如果执行),表明将获得专利的传播材料的选择退出是合法的。我们想从总统内听到该措施的影响是否已被评估。Art 10BIS我们想从总统职位上听到是否已经研究了种子标签的实际影响,特别是当地位从“申请申请”到“受专利保护”或拒绝申请专利时。是否认为获得专利的非NGT植物不会被标记?这背后的理由是什么?为什么如果信息包含在目录中,反之亦然,为什么要标记PRM?Art 11Bis应该1。(c)被视为与申请人达成专利的第三方,或者是申请专利的所有潜在当事方?
附录A PIC联系人列表,通知,...
保护局Dobbyn Jon(Sandy)高级战略顾问Niagara Esparpment Commission 232 Guelph Street Georgetown,l7g 4b1 sandy.dobbyn@ontario.ca项目潜在影响Adair Kendair Kendra高级计划者Niagara Esparpment Commits Niaerph Street spsergern niaia niaia niaia nia.airaia.Arra.Adra。 Escarpment Commission 232 Guelph Street Georgetown, ON L7G 4B1 janet.sperling@ontario.ca Menyes Katherine Director, Watershed Planning & Engineering Hamilton Conservation Authority 838 Mineral Springs Road, Box 81067 Ancaster, ON L9G 4X1 kmenyes@conservationhamilton.ca Stone Michael Manager, Watershed Planning Services Hamilton Conservation Authority 838 Mineral Springs路Box 81067 Ancaster,l9g 4x1 mike.stone@conservationhamilton.ca class eas of
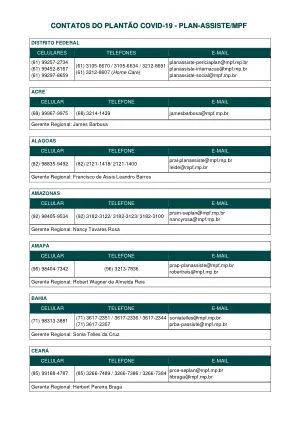
COVID-19 值班联系人 - PLAN-ASSISTE/MPF
PRSP-planassistebeneficios@mpf.mp.br PRSP-planassistecontasmedicas@mpf.mp.br PRSP-planassistecredenciamento@mpf.mp.br PRSP-planassisteautorizacoes@mpf.mp.br PRSP-planassistegerencia@mpf.mp.br
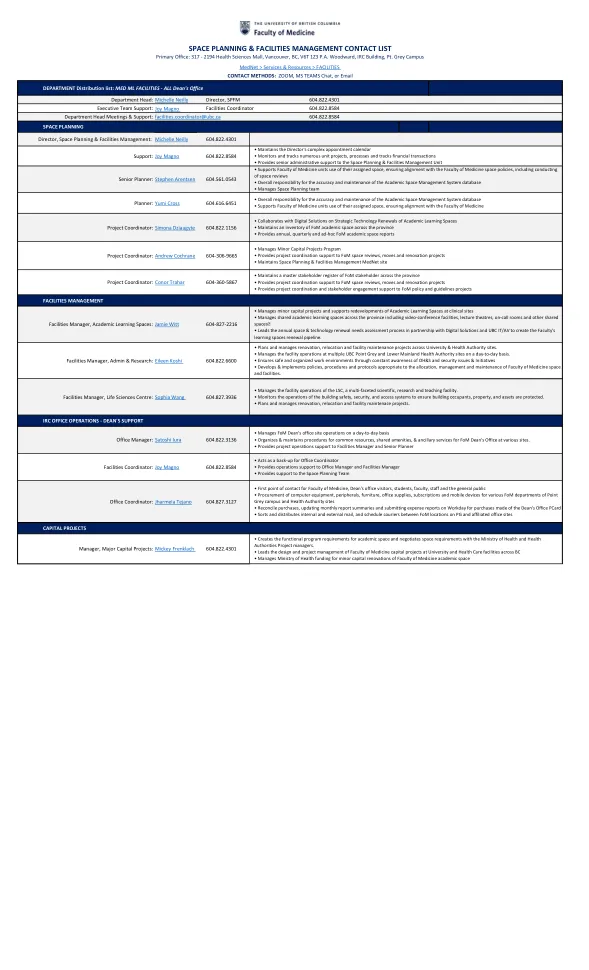
空间规划和设施管理联系人列表
••医学院教师,院长的办公室访客,学生,教职员工和公众的接触内部和外部邮件,并安排PG和附属办公地点的FOM位置之间的快递员•医学院教师,院长的办公室访客,学生,教职员工和公众的接触内部和外部邮件,并安排PG和附属办公地点的FOM位置之间的快递员
CM 1192/25 1联系人:Coreper.2@consilium.europa.eu ...
11。2018年3月15日的理事会建议在欧洲的质量和有效学徒制框架上(OJ C 153,2.5.2018,p。1 - 6)。12。理事会于2020年10月30日提出了一座桥梁的建议 - 加强了青年担保,并取代了2013年4月22日建立青年担保的理事会建议(OJ C 372,4.11.2020,第1-9页)。13。2022年6月16日的理事会建议欧洲对终身学习和就业能力微观的方法(OJ C 243,27.6.2022,p。10 - 25)。14。法规(EU)2021/1057欧洲议会和2021年6月24日的理事会建立欧洲社会基金加(ESF+)和废除法规(EU)第1296/2013号(OJ L 231,30.6.6.2021,第21-59页)。15。一个例子是提供给“ Collectief Maatwerk”的比利时支持,其中包括对工作融合社会企业的财务支持。
场地联系人注册创新在实践中:
是一名医生,研究人员,创新者和公共健康专家,Ran Balicer为在医疗保健系统中的预测分析和数字健康解决方案的整合铺平了道路,为其贡献赢得了国际荣誉。他在现实世界数据应用中的开创性工作已提高早期疾病检测,个性化的医疗和人群健康管理。