XiaoMi-AI文件搜索系统
World File Search SystemRAS 介导的肿瘤应激适应及其提供的靶向机会
简介 RAS 通路通过激活调节多种生物过程(包括细胞生长、分裂和分化)的基因来响应外部生长因子。该通路始于生长因子与细胞表面的同源受体结合,导致小 GTPase RAS 的三种异构体(HRAS、KRAS 和 NRAS)的激活。RAS 激活会启动多个信号级联,最终导致转录因子的激活,例如 c-Myc(也称为 MYC)、c-JUN(也称为 JUN)以及 ETS 和 CREB 蛋白(Chang 等人,2003 年)。由于获得 RAS 中的激活突变而导致的 RAS 通路过度激活是恶性转化的起始事件;大约 19% 的癌症患者携带 RAS 基因之一的激活突变(Prior 等人,2020 年)。因此,这种普遍存在的致癌驱动因素为治疗多种癌症亚型提供了一个绝佳的靶点。然而,由于多种原因,在临床环境中抑制 RAS 蛋白已被证明具有挑战性(Choi et al., 2019)。这些原因包括其活性位点隐藏在蛋白质深处,因此无法与小分子结合,其对 GTP 的亲和力高,以及特定 RAS 突变体的结构和水解速率存在差异(Smith et al., 2013; Cagir and Azmi, 2019)。多项研究表明,致癌 RAS 和细胞应激共同驱动肿瘤发生。细胞应激是一把双刃剑,它促进肿瘤发生,但也可能导致细胞
胚胎生殖细胞的高分辨率多尺度分析...
原始生殖细胞(PGC)是配子的胚胎前体。在小鼠和大鼠中,PGC可以通过形成胚胎生殖细胞(EGC)轻松地在体外获得多能性。迄今为止,尽管人类PGC(HPGC)在生殖细胞肿瘤发生的背景下很容易经历多能转化,但在人类中尚未建立可比的体外系统。在这里,我们报告说,HPGC样细胞(HPGCLC)在暴露于先前用于得出小鼠EGC的相同感应信号后经历人类胚胎类细胞(HEGCLC)。这种定义的无馈物培养系统允许有效地推导人EGCLC,可以在标准的人类多能干细胞培养基中扩展和维持。HEGCLC在转录上与人类多能干细胞(HPSC)相似,并且可以区分所有三个细菌层,并再次引起PGCLC,证明了多能状态的互助性。这在表观遗传水平上也很明显,因为在HPGCLC中发生的初始DNA脱甲基化在HEGCLC中很大程度上逆转,将DNA甲基恢复到HPSC中观察到的水平。这种新的体外模型捕获了从多能干细胞状态到生殖细胞身份并再次返回的过渡,因此代表了一个高度可牵引的系统,用于研究多能和表观遗传转变,包括在人类生殖细胞肿瘤发生过程中发生的多能和表观遗传转变。
分子途径和相关的靶向疗法
简单的摘要:软组织肉瘤是来自间质起源的极为罕见的癌症。sts很难治疗,因为它们的各种组织学亚型决定了其个体的肿瘤发生和临床特征。尽管传统的化学疗法仍然是晚期和转移性疾病的主要治疗方法,但靶向疗法已成为一种有希望的新方法,可以基于肿瘤的特定分子途径来治疗STS。进一步阐明与ST开发有关的分子途径将有助于指导有望有效瞄准这些途径的有希望的新疗法的发展。因此,在临床研究中测试了许多针对STS的靶向疗法,以评估这些新疗法的效率和安全性。
FGFR基因变异实体肿瘤诊疗专家共识
1 中国科学院肿瘤与基础医学研究所科研处,浙江杭州 310022,中华民国 2 南京大学医学院附属金陵医院呼吸内科,江苏南京,中华民国 3 北京大学肿瘤医院暨肿瘤研究所黑色素瘤与肉瘤研究室,教育部肿瘤发生及转化研究重点实验室,北京,中华民国 4 第三军医大学(陆军军医大学)西南医院肿瘤科和西南肿瘤中心,重庆,中华民国 5 南京中医药大学附属医院、江苏省中医院呼吸内科,江苏南京,中华民国 6 中国科学院大学肿瘤医院(浙江省肿瘤医院)化疗科,浙江杭州,中华人民共和国中华民国
成纤维细胞生长因子受体信号传导失调和乳腺癌的靶向
成纤维细胞生长因子受体(FGFR)信号传导在乳腺胚胎发育,组织稳态,肿瘤发生和转移中起关键作用。fgfr,其众多的FGF配体和信号伴侣在乳腺癌的进展中常常失调,并且是乳腺癌治疗耐药的原因之一。此外,上皮细胞上的FGFR信号受到乳房微环境信号的影响,因此增加了乳房发育异常或癌症进展的可能性。我们对复杂的FGFR家族,配体FGF及其调节伙伴的多层作用的了解可能会为乳腺癌患者提供新颖的治疗策略,作为单个药物或理性的共同靶向,这将在本综述中深入探讨。
RXR 信号靶向癌症治疗 - 创新
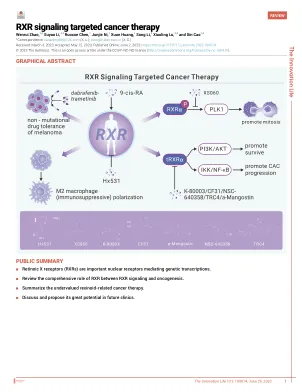
4 这些作者对这项工作做出了同等贡献。 *通信:luxiaoling80@126.com(XL);caox@fudan.edu.cn(XC) 收到:2023 年 3 月 3 日;接受:2023 年 5 月 12 日;在线发表:2023 年 6 月 2 日;https://doi.org/10.59717/j.xinn-life.2023.100014 © 2023 作者。这是一篇根据 CC BY-NC-ND 许可开放获取的文章(http://creativecommons.org/licenses/by-nc-nd/4.0/)。引用:Zhao W.、Li S.、Chen R. 等人,(2023 年)。RXR 信号靶向癌症治疗。创新生命 1(1), 100014。视黄酸 X 受体 (RXR) 是调节癌细胞中一系列基因转录的关键因素,因为它与三分之一的核受体 (NR) 形成异二聚体。然而,以 RXR 为靶点的癌症治疗被大大低估了。贝沙罗汀 (Targretin®) 是第一个合成的视黄酸类药物,于 2000 年获得美国食品和药物管理局批准用于治疗难治性皮肤 T 细胞淋巴瘤。此后,研究人员开始更多地关注 RXR 的功能和 RXR 的修饰,例如磷酸化-RXRα (p-RXRα) 和截短的 RXRα (tRXRα)。同时,由于RXR在肿瘤发生中具有重要而全面的调控作用,调节RXR的药物因具有干扰癌细胞增殖、分化和凋亡的潜力而开始引起肿瘤学家的更多兴趣。本文,我们将综述RXR在RXR信号传导和肿瘤发生之间的综合作用,重点关注被低估的与Rexinoid相关的癌症治疗,并讨论和提出其在未来临床中的巨大潜力。
HER2阳性胃癌患者的治疗策略
胃癌(GC)在全球范围内是一个主要的健康问题,在频率上排名第五,与癌症相关的死亡率排名第四。在中国,估计每年诊断出396,500例新病例,后期疾病占病例2的80%以上。由于诊断晚期和异性特征,GC的预后仍然很差。对于患有晚期疾病的患者,传统的化疗一直是治疗的主要手段,但其临床结果远非令人满意,5年的存活率低于10%。在过去的几十年中,有针对性的治疗和免疫疗法的进展取得了无与伦比的改善,精确肿瘤学方面的进步。对于GC,人类表皮生长因子受体2(HER2,也称为ERBB2)是药物干预措施的主要目标,并有望将来临床应用。ERBB2的扩增可以诱导HER2蛋白的过表达,并导致表皮生长因子受体(EGFR)成员的异二聚体ization,从而激活一系列信号通路并促进肿瘤发生。 曲妥珠单抗的成功导致了GC靶向疗法的新时代,并使Her2阳性亚组成为独特的疾病实体,占所有GC病例的15%–20%。 但是,遵循乳腺癌后的路径,ERBB2的扩增可以诱导HER2蛋白的过表达,并导致表皮生长因子受体(EGFR)成员的异二聚体ization,从而激活一系列信号通路并促进肿瘤发生。曲妥珠单抗的成功导致了GC靶向疗法的新时代,并使Her2阳性亚组成为独特的疾病实体,占所有GC病例的15%–20%。但是,遵循乳腺癌后的路径,
神经生长因子和炎症在...中的作用 - IRIS
摘要:神经生长因子 (NGF) 在炎症状态和癌症中都发挥双重作用,既可作为促炎和致癌因子,又可作为抗炎和促凋亡介质,其作用取决于信号网络及其与微环境内各种细胞成分的相互作用。本报告旨在总结并随后回顾 NGF 在调节炎症微环境和肿瘤细胞生长、存活和死亡方面的作用的文献。本文重点介绍了 NGF 作为炎症系统的一个组成部分在炎症和肿瘤发生中的作用、它与各自微环境的各个成分的相互作用、它引起表观遗传变化的能力以及它在癌症治疗中的作用。
小胶质细胞在脑健康和疾病中的ins和outs
小胶质细胞是大脑的常驻巨噬细胞,它们在免疫监测和维持中枢神经系统(CNS)的体内平衡中起关键作用。小胶质细胞在功能上与各种脑血管疾病有关,包括中风,动脉瘤和肿瘤发生,它们调节神经蛋白的流动性反应和组织修复过程。在这里,我们回顾了在生理和病理条件下小胶质细胞在大脑中的多种功能,主要集中于小胶质细胞在神经胶质瘤传播和进展中的影响。我们进一步审查针对小胶质细胞的疗法的当前状态,包括重新教育,耗尽和种群方法作为治疗选择,以改善包括癌症在内的各种神经和神经毒素疾病的患者结局。
DNA连接酶4抑制使前列腺癌敏感到体内免疫检查点阻滞
抽象背景/目标:前列腺癌是男性常见的恶性肿瘤。DNA连接酶IV(LIG4)表达与前列腺癌患者的预后不良相关。Lig4连接DNA双链断裂,是这些遗传病变的必不可少的或修复。前列腺癌尚未表现出对抗PD − 1免疫疗法的临床显着反应。前列腺癌表达较低的PD − L1水平,并表现出有限的细胞毒性T淋巴细胞浸润。为了确定lig4对前列腺肿瘤发生的抑制作用,我们创建了一种在体内模型中进行的新基因设计。材料和方法:LIG4+/+; TAG和LIG4 +/-; TAG前列腺和肿瘤进行了组织病理学。用抗PD1抗体或免疫前IgG治疗前列腺肿瘤的单独组。Lig4和Pd -L1表达。通过免疫组织化学和免疫荧光显微镜确定DNA损伤修复蛋白,细胞衰老和细胞死亡标记的表达。通过SCA1/CD49 F流式细胞仪和肿瘤培养物分析了前列腺癌干细胞F疗法。pd- L1蛋白表达通过蛋白质印迹确定。结果:LIG4抑制作用诱导前列腺和癌症中的DNA双链断裂和细胞衰老,并显着降低了前列腺内上皮内肿瘤和肿瘤发生。Lig4抑制作用降低了干细胞培养物中的前列腺癌干细胞F racte and Proli fration。前列腺癌对Lig4抑制作用抗性抗肿瘤免疫反应,这是由于PD − L1表达增加而导致的。PD − 1抗体治疗。结论:抑制Lig4敏化前列腺癌对免疫检查点抑制。关键字:DNA损伤,衰老,编程的死亡受体1,凋亡,癌症干细胞。