XiaoMi-AI文件搜索系统
World File Search System世卫组织疫苗可预防疾病:监测系统。2020 年全球摘要
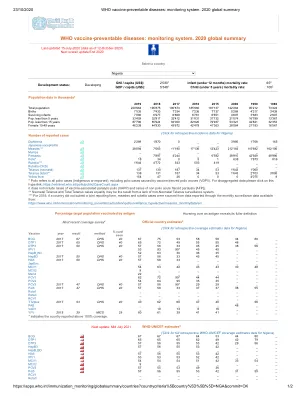
白喉 2'289 1'870 0 _ _ 3'995 1'768 165 日本脑炎 _ _ _ _ _ _ _ _ 麻疹*** 28'094 7'063 11'190 17'136 12'423 212'183 115'682 162'106 腮腺炎 _ _ _ _ _ _ _ _ 百日咳 _ 7'897 4'244 _ 6'592 38'910 42'929 48'996 脊髓灰质炎* 18 34 0 5 1 638 1'873 816 风疹*** 1'644 4'772 543 503 419 _ _ _ 风疹 (CRS) _ _ _ _ _ _ _ _ 破伤风 (新生儿) 137 130 187 34 53 1'643 1'060 _ 破伤风 (总数)** 138 131 187 34 53 1'643 2'703 3'095 黄热病 154 47 26 0 0 0 4'075 8 * 脊髓灰质炎指所有脊髓灰质炎病例(本土或输入),包括由疫苗衍生脊髓灰质炎病毒 (VDPV) 引起的脊髓灰质炎病例。如需分类数据,请点击此超链接:https://extranet.who.int/polis/public/CaseCount.aspx 它不包括疫苗相关麻痹性脊髓灰质炎 (VAPP) 病例和非脊髓灰质炎急性弛缓性麻痹 [AFP] 病例。 ** 新生儿破伤风和总破伤风病例数相等可能是由于缺乏非新生儿破伤风监测系统。*** 对于 2019 年,如果一个国家没有提交联合报告表,则麻疹和风疹病例来自通过每月监测数据报告的数据,可从以下网站获取:https://www.who.int/immunization/monitoring_surveillance/burden/vpd/surveillance_type/active/measles_monthlydata/en/
脊髓灰质炎病毒
今天有两种基本类型的脊髓灰质炎疫苗:使用活病毒的活病毒,灭活(或注射)脊髓灰质炎疫苗(IPV)和口服脊髓灰质炎疫苗(OPV)。两种疫苗都赋予体液免疫(血液中的抗体),使其在预防麻痹性脊髓灰质炎方面非常有效。IPV不含任何活病毒;一个缺点是,这种疫苗不能有效地阻止肠道中的病毒复制,这意味着IPV接种疫苗的人在暴露时仍可以通过粪便传播病毒。 (IPV是美国唯一可用的类型。) 相比之下,OPV确实赋予了肠道的免疫力,这对于尚未消除脊髓灰质炎的地区中断传播至关重要。 OPV也相对便宜且易于管理。 但是,有两种方式从OPV开发小儿麻痹症的风险很少:IPV不含任何活病毒;一个缺点是,这种疫苗不能有效地阻止肠道中的病毒复制,这意味着IPV接种疫苗的人在暴露时仍可以通过粪便传播病毒。(IPV是美国唯一可用的类型。)相比之下,OPV确实赋予了肠道的免疫力,这对于尚未消除脊髓灰质炎的地区中断传播至关重要。OPV也相对便宜且易于管理。 但是,有两种方式从OPV开发小儿麻痹症的风险很少:OPV也相对便宜且易于管理。但是,有两种方式从OPV开发小儿麻痹症的风险很少:
脊髓灰质炎病毒控制的要点
• 1 型野生脊髓灰质炎病毒 (WPV1) 是唯一仍在传播的自然产生的脊髓灰质炎病毒株。2015 年 9 月,全球消灭脊髓灰质炎认证委员会 (GCC) 宣布已消灭 2 型野生脊髓灰质炎病毒 (WPV2),2019 年 10 月,该委员会宣布已消灭 3 型野生脊髓灰质炎病毒 (WPV3)。 • 消灭 WPV2 和 WPV3 意味着这些病毒不再存在于社区或环境中。然而,世界各地的一些机构仍在使用和储存这些毒株,用于疫苗生产或研究目的。 • 2016 年 4 月,世界各国停止在儿童常规免疫计划中使用 2 型口服脊髓灰质炎疫苗 (OPV2)。OPV2 目前仅用于应对一些国家仍在发生的 2 型循环疫苗衍生脊髓灰质炎病毒 (cVDPV2) 疫情。 3 型口服脊髓灰质炎疫苗 (OPV3) 在许多国家继续常规使用,作为预防 1 型和 3 型脊髓灰质炎的二价口服脊髓灰质炎疫苗的一部分。OPV 由减毒活脊髓灰质炎病毒株制成。所有 2 型和特定 3 型脊髓灰质炎病毒材料必须销毁或适当保存
孩子的疫苗接种时间表
学龄前儿童四价疫苗 *第一剂,**第二剂,***第三剂 六价疫苗可预防白喉、破伤风、百日咳、脊髓灰质炎、乙型流感嗜血杆菌和乙型肝炎 四价疫苗可预防白喉、破伤风、百日咳和脊髓灰质炎
多头疫苗接种到风险区域的指南 div>
从过去3年中全球肺小鼠爆发的情况下,仍然发现了爆发。来自天然脊髓灰质炎病毒(WPV)物种1的患者以及寻找脊髓灰质炎患者的趋势。从循环疫苗衍生的脊髓灰质炎病毒(CVDPV)中,许多国家有所增加。其中包括泰国附近的国家,包括印度尼西亚还发现了第二种繁殖疫苗(CVDPV2)的脊髓灰质炎病毒爆发和爆发的报道。因此,感染的风险很高脊髓灰质炎病毒在泰国传播。尤其是覆盖低疫苗的脊髓灰质炎流行病地区的附近地区可能会增加未来寻找脊髓灰质炎的风险
日期:2022 年 9 月 28 日 致:医疗保健提供者...
• 非麻痹性脊髓灰质炎(非特异性病毒症状或脑膜炎)的加强监测范围已扩大到纽约市以外的县,这些县已发现与病例病毒株遗传相关的脊髓灰质炎病毒。截至本通报发布之日,这些县包括:罗克兰、奥兰治、沙利文和拿骚。加强监测范围包括未接种或未接种脊髓灰质炎疫苗的个人,以及在这些县居住、工作、上学或与社区有频繁社交互动的个人。请参阅以下详细信息。• 与非特异性病毒症状的加强监测活动一致,脑膜炎的监测活动仅限于未接种或未接种脊髓灰质炎疫苗的个人。请参阅以下详细信息。 • 下文中成人脊髓灰质炎疫苗接种建议已根据截至 2022 年 9 月 22 日的 CDC 更新建议进行了更新。 • 在美国出生和长大的成年人可以假设他们小时候接种过脊髓灰质炎疫苗,除非有具体理由相信他们没有接种过疫苗。如果有风险的成年人有理由相信他们没有接种过疫苗,并且无法轻松快速地获得记录,则应将其视为未接种过疫苗。脊髓灰质炎免疫接种自 1955 年以来一直存在,几十年来一直是常规儿童免疫接种计划的一部分。 • 自 2022 年 9 月 9 日起至 2022 年 10 月 9 日,根据纽约州 (NYS) 州长 Kathy Hochul 的第 21.0 号行政命令,纽约州医疗补助按服务收费 (FFS) 和医疗补助管理式医疗 (MMC) 计划涵盖灭活脊髓灰质炎疫苗 (IPV),用于向医疗补助 FFS 和 MMC 成员提供 IPV。纽约州医疗补助提供者应遵循纽约州卫生部 (DOH) 医疗补助更新文章 8 月版中提供的脊髓灰质炎疫苗及其管理的覆盖范围和计费指南。根据访问时间,可以在 DOH 医疗补助更新网页的“当前问题”部分或“存档问题”部分找到该文章,网址为:https://www.health.ny.gov/health_care/medicaid/program/update/main.htm。本文为第 28 条机构、私人医生、学校健康中心、联邦合格健康中心和 Medicaid 管理式医疗服务提供者提供了计费说明(包括疫苗咨询)。订购和计费脊髓灰质炎疫苗时,请参考本文。
低剂量白喉、破伤风和灭活脊髓灰质炎疫苗 (Td/IPV) 患者组指导 (PGD)
必须熟悉疫苗产品并注意产品特性摘要 (SPC)、传染病免疫 (“绿皮书”) 以及国家和地方免疫计划的变化 • 必须接受适合此 PGD 的培训,以满足当地政策的要求并符合国家免疫培训最低标准和核心课程 • 必须有能力进行免疫接种并讨论与免疫接种有关的问题 • 必须有能力处理和储存疫苗以及管理“冷链” • 必须有能力识别和管理过敏反应 • 必须能够访问 PGD 和相关的在线资源 • 应满足当地政策定义的任何其他要求
您孩子的疫苗接种时间表
• 入学前每 4 剂加强剂中注射 1 剂 * 第一剂,** 第二剂,*** 第三剂 B 型疫苗可预防白喉、破伤风、百日咳、脊髓灰质炎、流感和 B 型流感嗜血杆菌。乙肝疫苗可以预防白喉、破伤风、百日咳和脊髓灰质炎。四分之一
全球卫生公共产品——nOPV2 给我们的启示。......
根除传染病是实现卫生领域全球公共利益的一个例子。迄今为止,人类中只有一种传染病——天花被根除。根除脊髓灰质炎被视为全球卫生公共利益,因为一旦实现,它将为所有国家带来普遍利益,不会排除任何人或区分任何群体。根除脊髓灰质炎需要集体努力,并带来健康和经济效益。新型口服脊髓灰质炎疫苗 2 型 (nOPV2) 的开发可以作为开发和提供其他全球卫生公共利益的典范,例如预防(重新)出现的传染病,例如过去几十年占新发疾病 75% 以上的人畜共患疾病。2