XiaoMi-AI文件搜索系统
World File Search System2020 年——赛诺菲
前瞻性陈述 本报告包含经修订的 1995 年私人证券诉讼改革法所定义的前瞻性陈述。前瞻性陈述是非历史事实的陈述。这些陈述包括预测和估计及其基本假设、关于未来财务结果、事件、运营、服务、产品开发和潜力的计划、目标、意图和期望的陈述,以及关于未来业绩的陈述。前瞻性陈述通常用“预期”、“预计”、“相信”、“打算”、“估计”、“计划”等词语和类似表述来表示。尽管赛诺菲管理层认为此类前瞻性陈述所反映的预期是合理的,但投资者仍需注意,前瞻性信息和陈述受各种风险和不确定性的影响,其中许多风险和不确定性难以预测且通常超出赛诺菲的控制范围,可能导致实际结果和发展与前瞻性信息和陈述中表达、暗示或预测的结果和发展存在重大差异。这些风险和不确定性包括但不限于:研发固有的不确定性、未来临床数据和分析(包括上市后数据和分析)、FDA 或 EMA 等监管机构关于是否以及何时批准可能为此类候选产品提交的任何药物、设备或生物申请的决定以及它们关于标签和其他可能影响此类候选产品的可用性或商业潜力的事项的决定、候选产品即使获得批准也可能无法获得商业成功、治疗替代品的未来批准和商业成功、赛诺菲从外部增长机会中获益的能力、完成相关交易和/或获得监管批准的能力、与知识产权相关的风险以及任何相关的未决或未来诉讼以及此类诉讼的最终结果、汇率趋势和现行利率、不稳定的经济和市场条件、成本控制举措及其后续变化,以及 COVID-19 对我们、我们的客户、供应商、供应商和其他业务合作伙伴以及他们中任何一个的财务状况以及我们的员工的影响以及对全球经济整体的影响。COVID-19 对上述任何一项产生的任何重大影响也可能对我们产生不利影响。这种情况正在迅速变化,可能会产生我们目前尚不了解的其他影响,并可能加剧其他先前确定的风险。风险和不确定性还包括赛诺菲向美国证券交易委员会和法国金融市场管理局提交的公开文件中讨论或确定的不确定性,包括赛诺菲截至 2020 年 12 月 31 日的 20-F 表年度报告中“风险因素”和“前瞻性陈述警示声明”下列出的不确定性。除适用法律要求外,赛诺菲不承担更新或修改任何前瞻性信息或声明的义务。
2022 赛诺菲 20-F
请勾选表明注册人是否为《证券法》第 405 条定义的知名成熟发行人。是 ☒ 否 ☐。如果本报告为年度报告或过渡报告,请勾选表明注册人是否无需根据《1934 年证券交易法》第 13 或 15(d) 条提交报告。是 ☐ 否 ☒。请勾选表明注册人 (1) 在过去 12 个月内(或注册人需要提交此类报告的更短时间内)提交了《1934 年证券交易法》第 13 或 15(d) 条要求提交的所有报告,以及 (2) 在过去 90 天内是否一直遵守此类提交要求。是 ☒ 否 ☐。请勾选表明注册人在过去 12 个月内(或注册人被要求提交此类文件的更短时间内)是否已以电子方式提交了根据 S-T 条例第 405 条(本章第 232.405 节)要求提交的每个交互式数据文件。 是 ☒ 否 ☐ 。请勾选表明注册人是大型加速申报人、加速申报人、非加速申报人还是新兴成长型公司。请参阅《交易法》第 12b-2 条中对“大型加速申报人”、“加速申报人”或“新兴成长型公司”的定义。
赛诺菲第二季度新闻稿
“2024 年,我们将延续强劲表现,第二季度实现两位数的全面销售增长。我们的新药研发管线也取得了重要进展,包括 Dupixent(用于治疗 COPD)、Kevzara(用于治疗儿童关节炎)和 ALTUVIIIO(用于治疗 A 型血友病)。随着欧盟批准用于治疗 COPD,Dupixent 成为首个获批用于治疗这种影响全球数十万患者的致残性疾病的生物药物。随着我们加快重点中后期研发管线,我们启动了多项新的 2 期和 3 期研究,这些研究将在未来造福患者。我们正按计划顺利推进,实现赛诺菲的战略重点,成为一家以发展为导向、以技术为驱动的生物制药公司,致力于服务患者并加速增长。在加速实现赛诺菲转型的推动下,我们上调了 2024 年每股收益预期。”
企业社会责任 - 赛诺菲
为了对这些风险和问题对外部利益相关者的 CSR 影响进行排名,我们使用了九个多学科工作组的结果,每个工作组的任务是评估每个风险或问题对一个或多个特定利益相关者群体的重要性:员工;患者;医疗保健专业人员;卫生当局和付款人;业务合作伙伴;投资者;当地社区;国际和当地组织;媒体。该过程的结果是一份包含八个 SEFP 风险和三个 SEFP 问题的清单。这些内容在第 4.1.3 节的表格中进行了总结,并归类为立法中规定的非财务风险类别:社会和社会;人权;反腐败;环境。该表还显示了与未被确定为赛诺菲主要风险但需要在 SEFP 中披露的主题相关的 SEFP 要求。
赛诺菲巴斯德退货表格
1) 填写以下信息并创建此表单的 PDF 版本 2) 登录 Inmar 门户网站 https://returns.healthcare.inmar.com 并转至制造商退货 3) 选择您的退货计划为 SANOFI PASTEUR 4) 输入您在下面创建的参考/借记单编号*并填写必填字段 5) 将此表单的 PDF 版本上传至 Inmar 门户网站以接收您的退货授权 6) 在没有退货授权的情况下收到的退货可能会导致处理延迟
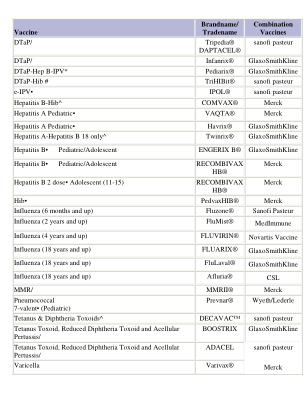
Tripedia® DAPTACEL® 赛诺菲巴斯德 DTaP
破伤风和白喉类毒素^ DECAVAC™ 赛诺菲巴斯德 破伤风类毒素、减毒白喉类毒素和无细胞百日咳/ BOOSTRIX 葛兰素史克
新闻稿 - 赛诺菲的突破性疗法Rezurock®...
仅使用注册医生,医院或实验室删节的处方信息,抗胸腺细胞免疫球蛋白(兔子)E.P.THYMOGLOBULINE ® 5mg/ml Powder for concentrate for a solution for infusion COMPOSITION After reconstitution with 5ml Water for Injection (WFI) I.P., the solution contains 5mg rabbit anti-human thymocyte immunoglobulin/ ml (concentrate) Corresponding to 25mg/5ml of rabbit anti-human thymocyte immunoglobulin per vial.治疗适应症•移植中的免疫抑制:预防和治疗移植排斥。•急性和慢性移植物与宿主疾病的预防在造血干细胞移植中。•治疗类固醇,急性移植物与宿主疾病的治疗。•血液学:性肿瘤的治疗。剂量和给药,供应取决于指示,给药方案以及可能与其他免疫抑制剂的组合。建议可以用作参考。可以停止治疗而不会逐渐减少剂量。在注入兔抗人胸腺细胞免疫球蛋白之前,需要服用剂量的皮质类固醇和抗组胺药。与安全相关的信息禁忌症:急性或慢性感染,这将禁止任何其他免疫抑制。对兔蛋白或任何产品赋形剂的过敏性。 妊娠和哺乳:除非绝对需要,否则不应给予胸腺球菌。 应停止喂养母乳喂养。 警告和预防措施:必须在医院环境中使用。对兔蛋白或任何产品赋形剂的过敏性。妊娠和哺乳:除非绝对需要,否则不应给予胸腺球菌。应停止喂养母乳喂养。警告和预防措施:必须在医院环境中使用。急性输注 - 相关反应(IARS),并且在胸腺球蛋白治疗的单一过程中,可能会在第一或第二次输注后立即发生。如果发生过敏性休克,则必须立即停止输液,并且任何进一步的给药才必须在福利和风险仔细权衡之后进行。已经确定了血小板减少症和/或白细胞减少症:在治疗期间和之后,必须监测白细胞和血小板计数。感染,感染的重新激活和败血症已在给予胸腺球菌与几种免疫抑制剂相关后。使用免疫抑制剂(包括胸腺球菌)可能会增加恶性肿瘤的发生率。在输注部位的反应可能会发生,并且可能包括疼痛,肿胀和红斑。对于最近接受胸腺球菌的患者,不建议使用衰减的活疫苗免疫接种。不良反应:感染(包括感染的重新激活),败血症,淋巴细胞增生性疾病,淋巴瘤(可能是病毒介导的),肿瘤恶性(实体瘤),高热中性细胞减少症,散发性肠内凝结性凝血病,凝乳蛋白疾病,凝乳酶释放(cytopoty),凝乳蛋白质释放(cy虫) (including reactions such as fever, rash, urticaria, arthralgia, and/or myalgia), Transaminases increased, Hepatocellular injury, Hepatotoxicity, Hepatic Failure, Infusion related reactions (Infusion associated Reactions (IARs) For full prescribing information please contact: Sanofi Healthcare India Private Limited, Sanofi House, CTS No.117-B,L&T商业园,Saki Vihar Road,Powai 400072更新:2024年2月来源:1)CCDS版本号。 2 2015年7月16日。 2)英国2015年5月3日的产品特征摘要。117-B,L&T商业园,Saki Vihar Road,Powai 400072更新:2024年2月来源:1)CCDS版本号。2 2015年7月16日。2)英国2015年5月3日的产品特征摘要。