XiaoMi-AI文件搜索系统
World File Search SystemAntonio Forte Ph.D.,M.D。合着者(S): - 利用
生成功能多能细胞衍生的脑内皮细胞,用于在脑内皮细胞(BECS)中高度专业的内皮细胞(ECS)进行体外建模和血液脑屏障的体外建模,与其他各种细胞类型相互作用,例如星形胶质细胞和诸如血液脑障碍(BBB)的基础(BBB)。BEC具有独特的特性,包括紧密连接,选择性渗透性和特定的运输系统,这些特性将它们与其他组织中的内皮细胞区分开。这些细胞在维持稳态大脑功能以及调节免疫系统和神经系统之间的相互作用方面起着至关重要的作用。人类神经血管单元(NVU)的体外模型的发展取决于使用EC的使用,该模型可以忠实地概括多个关键的器官功能。人类多能干细胞(HPSC) - 衍生的BMEC(IBMEC)已被广泛用于此目的;然而,其细胞身份的转录组和功能表征表明,这些细胞是上皮屏障形成细胞(Epi-IBFC)而不是BMEC。在这里,我们描述了转录因子介导的策略的开发,以从HPSC中产生EC及其用于生成3D NVU模型的使用。我们报告说,两个EC转录因子SOX7和ERG的构型过表达将Epi-iBFC转换为成人血管ECS(SE-REC),表达EC基因曲目并响应炎症提示。此外,在2D和3D中与星形胶质细胞和周细胞的共同文化在SE-REC中诱导BBB特异性的转录谱。在功能上,与单独培养的EC相比,在3D微流体系统中与原发性脑周细胞和星形胶质细胞的共同培养可显着降低对生物蛋白的渗透性,而70 kDa葡萄蛋白的渗透性与单独培养的EC相比,主要是由于诱导的紧密连接蛋白Claudin-5和Beceception concection claudin-5 and beccantion centection beccention begencecnecnection-beccection centectection-becceent centection beccente cenecnectection。我们旨在使用这些重编程的SE-REC在体外开发更忠实的人BBB系统,以了解疾病机制并开发用于向大脑输送药物的方法。
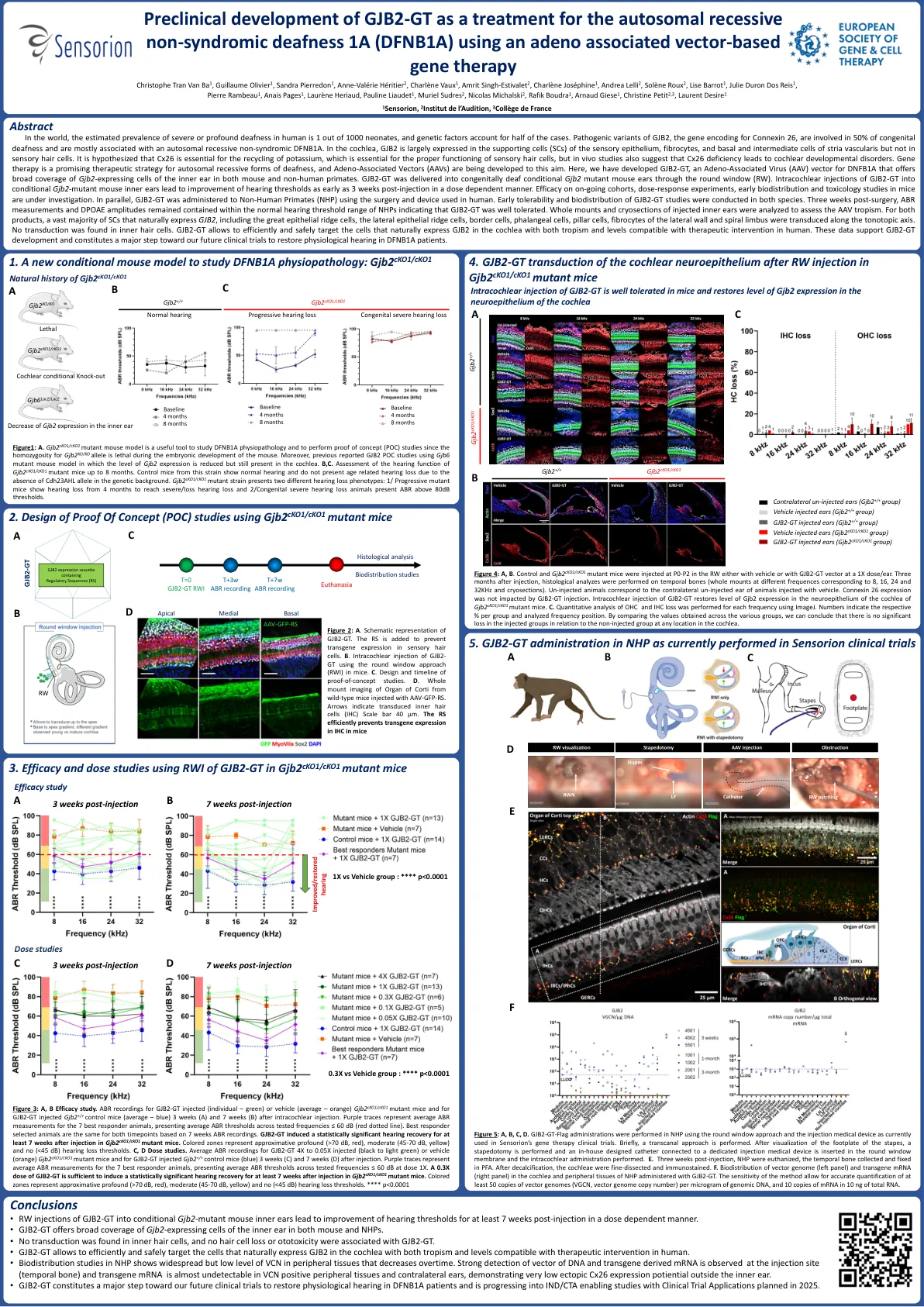
GJB2-GT作为... 的临床前开发 sens-501常染色体隐性非... 的基因治疗
在世界上,人类严重或深刻的耳聋的估计患病率是1000名新生儿中的1个,遗传因素占了一半的病例。 GJB2的致病变异,编码连接蛋白26的基因,涉及50%的先天性耳聋,主要与常染色体隐性遗传性非伴有伴有伴有dfnb1a有关。 在耳蜗中,GJB2在感官上皮,纤维细胞,基底和中间细胞的血管毛血管的辅助细胞(SC)中主要表达,但在感觉毛细胞中却没有。 据推测,CX26对于钾的回收至关重要,这对于感觉毛细胞的正确功能至关重要,但是体内研究还表明CX26缺乏会导致耳蜗发育障碍。 基因疗法是一种有前途的聋哑形式的有前途的治疗策略,并且正在为此目的而开发与腺相关的载体(AAV)(AAVS)。 在这里,我们开发了GJB2-GT,这是DNFB1A的腺相关病毒(AAV)载体(AAV)载体,可在小鼠和非人类灵长类动物中均提供GJB2表达内耳gjb2表达细胞的广泛覆盖范围。 gjb2-gt通过圆形窗口(RW)传递到先天性聋哑的GJB2突变小鼠耳朵中。 对条件GJB2的gjb2-GT对有条件的小鼠内耳的注射会导致听力阈值在注射后3周以剂量依赖的方式改善。 对持续的队列,剂量反应实验,早期生物分布和毒理学研究的功效正在研究中。 并行,使用人类使用的手术和装置将GJB2-GT用于非人类灵长类动物(NHP)。在世界上,人类严重或深刻的耳聋的估计患病率是1000名新生儿中的1个,遗传因素占了一半的病例。GJB2的致病变异,编码连接蛋白26的基因,涉及50%的先天性耳聋,主要与常染色体隐性遗传性非伴有伴有伴有dfnb1a有关。在耳蜗中,GJB2在感官上皮,纤维细胞,基底和中间细胞的血管毛血管的辅助细胞(SC)中主要表达,但在感觉毛细胞中却没有。据推测,CX26对于钾的回收至关重要,这对于感觉毛细胞的正确功能至关重要,但是体内研究还表明CX26缺乏会导致耳蜗发育障碍。基因疗法是一种有前途的聋哑形式的有前途的治疗策略,并且正在为此目的而开发与腺相关的载体(AAV)(AAVS)。在这里,我们开发了GJB2-GT,这是DNFB1A的腺相关病毒(AAV)载体(AAV)载体,可在小鼠和非人类灵长类动物中均提供GJB2表达内耳gjb2表达细胞的广泛覆盖范围。gjb2-gt通过圆形窗口(RW)传递到先天性聋哑的GJB2突变小鼠耳朵中。对条件GJB2的gjb2-GT对有条件的小鼠内耳的注射会导致听力阈值在注射后3周以剂量依赖的方式改善。对持续的队列,剂量反应实验,早期生物分布和毒理学研究的功效正在研究中。并行,使用人类使用的手术和装置将GJB2-GT用于非人类灵长类动物(NHP)。在这两种物种中均进行了GJB2-GT研究的早期耐受性和生物分布。 手术后三周,ABR测量和DPOAE振幅保留在NHP的正常听力阈值范围内,表明GJB2-GT耐受性良好。 分析了注射的内耳的整个安装和冷冻切片,以评估AAV的偏向主义。 对于这两种产品,绝大多数自然表达GJB2的SC,包括大上皮脊细胞,侧皮脊细胞,边界细胞,圆锥细胞,柱状细胞,侧壁的纤维细胞,侧壁和螺旋状肢体的纤维细胞沿着负轴轴线进行传播。 在内毛细胞中未发现转导。 GJB2-GT允许有效,安全地靶向自然表达GJB2在耳蜗中的细胞,并具有与人类治疗干预兼容的水平。 这些数据支持GJB2-GT开发,并构成了我们未来的临床试验迈出的重大步骤,以恢复DFNB1A患者的生理听力。在这两种物种中均进行了GJB2-GT研究的早期耐受性和生物分布。手术后三周,ABR测量和DPOAE振幅保留在NHP的正常听力阈值范围内,表明GJB2-GT耐受性良好。分析了注射的内耳的整个安装和冷冻切片,以评估AAV的偏向主义。对于这两种产品,绝大多数自然表达GJB2的SC,包括大上皮脊细胞,侧皮脊细胞,边界细胞,圆锥细胞,柱状细胞,侧壁的纤维细胞,侧壁和螺旋状肢体的纤维细胞沿着负轴轴线进行传播。在内毛细胞中未发现转导。GJB2-GT允许有效,安全地靶向自然表达GJB2在耳蜗中的细胞,并具有与人类治疗干预兼容的水平。这些数据支持GJB2-GT开发,并构成了我们未来的临床试验迈出的重大步骤,以恢复DFNB1A患者的生理听力。
安斯泰来公司的 VYLOY™(佐贝妥昔单抗)在日本获批用于...
东京,2024 年 3 月 26 日——安斯泰来制药公司(TSE:4503,总裁兼首席执行官:Naoki Okamura,“安斯泰来”)今天宣布,2024 年 3 月 26 日,日本厚生劳动省 (MHLW) 批准了抗紧密连接蛋白 18.2 (CLDN18.2) 单克隆抗体 VYLOY™(zolbetuximab),用于治疗 CLDN18.2 阳性、不可切除、晚期或复发性胃癌患者。VYLOY 是全球首个也是唯一一个获得监管机构批准的 CLDN18.2 靶向疗法。由于早期症状与其他更常见的胃病重叠,胃癌通常在晚期或转移期才被诊断出来。 1 尽管日本努力减少胃癌的影响,但胃癌仍然是日本第三大致命癌症,2022 年诊断出 126,724 例。 2 Moitreyee Chatterjee-Kishore,博士,工商管理硕士,安斯泰来高级副总裁兼免疫肿瘤学开发主管 “厚生劳动省批准 VYLOY 标志着胃癌治疗的新时代,为患有这种毁灭性疾病的 CLDN18.2 阳性患者提供了第一个也是唯一的靶向治疗选择。安斯泰来很自豪能够帮助解决日本对这种难以治疗的癌症的迫切治疗需求,日本的发病率位居全球前列。重要的是,此次批准有可能为符合条件的患者提供更多宝贵的时间与亲人相处,兑现我们改善患者治疗效果的承诺。” SPOTLIGHT 试验首席研究员、日本柏市国立癌症中心东医院胃肠肿瘤科主任 Kohei Shitara 医学博士表示:“开发新的靶向疗法对于晚期胃腺癌等疾病至关重要,这种疾病的治疗选择非常有限,而且往往在晚期才被发现。作为 3 期 SPOTLIGHT 临床试验的首席研究员,我亲眼目睹了 VYLOY 联合化疗治疗患者的无进展生存期和总生存期与安慰剂联合化疗治疗患者的无进展生存期和总生存期相比有显著改善。这些结果支持 VYLOY 成为日本 CLDN18.2 阳性人群的新治疗选择,仅在 2022 年,日本就有近 44,000 人死于胃癌。”此次批准基于 3 期 SPOTLIGHT 和 GLOW 临床试验的结果,该试验针对局部晚期不可切除或转移性 HER2-
基于抗体的毒素和其他活性分子的癌症治疗
放射治疗和化疗药物在癌症治疗中的应用已显示出明显的抗肿瘤作用,但也有局限性(由于对肿瘤细胞缺乏选择性而产生显著的副作用、产生耐药性以及发生继发性恶性肿瘤)。因此,人们大力推动替代疗法(如免疫疗法)的研究和开发,以寻找对转化细胞具有更高特异性且非特异性毒性更低的疗法。免疫疗法的优势在于其特性(识别细胞膜上的特定靶标),这些特性完全独立于化疗和放疗所基于的参数。这导致副作用的叠加和对化疗和放疗有抗性的细胞克隆的细胞毒性不受影响。今天,受埃尔利希“魔法子弹”概念的启发,最有前途的研究方法之一是将药理活性分子与载体(主要是抗体)连接起来,以便选择性地递送到靶细胞。这些杂合物主要应用于癌症治疗领域的研究 [ 1 ]。因此,大多数免疫治疗方法都集中于针对癌细胞表面的特定抗原。这种方法的一个基本要求是靶分子局限于要破坏的细胞群,或者至少靶分子不存在于干细胞或其他对生物体生存至关重要的细胞类型中。抗体是最常用的载体,因为它们在血液中稳定,并且对靶抗原具有亲和力和亲和力。许多不同的分子已被用作毒性部分;研究最多的是毒素(细菌或植物)、药物、放射性核素和人类酶。最常用的细菌毒素是假单胞菌外毒素 A (PE) [ 2 ] 和白喉毒素 (DT) [ 3 ],它们通过 NAD 依赖的延长因子 2 的 ADP 核糖基化抑制翻译,导致细胞死亡。最常用于治疗目的的植物毒素是核糖体失活蛋白 (RIP) [ 4 , 5 ],主要是蓖麻毒素 [ 6 ] 和皂草毒素 [ 7 ]。RIP 也称为多核苷酸:腺苷糖基化酶 [ 8 ],因为它们能够从许多不同的多核苷酸底物中去除腺嘌呤,通过多种机制导致细胞死亡 [ 9 – 11 ]。本期特刊汇集了五篇科学文章,重点介绍了基于抗体的毒素和其他活性分子对抗恶性细胞的知识进展,从而揭示了它们在抗癌治疗中的潜力。如上所述,识别/选择有效靶标是针对特定癌症进行免疫治疗的战略重要行动。连接蛋白细胞粘附分子 4 (NECTIN4) 是皮肤鳞状细胞癌的潜在治疗靶标,第二种最常见的皮肤癌。在大多数皮肤鳞状细胞癌研究组织和 A431 细胞系的质膜上均发现了 NECTIN4 的表达。NECTIN4 被证实在调节细胞间相互作用、皮肤鳞状细胞癌细胞的迁移和增殖中发挥作用 [12]。前列腺特异性膜抗原 (PSMA) 是一种可靠的标记物,非常适合前列腺癌 (PCa) 的成像和治疗。抗 PSMA 抗体的有效性
病毒疾病中的反应性星形胶质细胞:朋友还是敌人?
在健康的大脑中,星形胶质细胞在神经元传播和血液 - 脑屏障(BBB)完整性中起着至关重要的作用。星形胶质细胞向反应状态的转化构成了中枢神经系统(CNS)对侮辱和大脑环境变化的生物学反应。众所周知,星形胶质细胞可以独立于神经元复制和积累王子[1-5]。然而,对它们的反应性转移对神经元功能和神经变性的影响知之甚少。在prion疾病中,反应性星形胶质细胞的有益作用似乎与星形胶质细胞生产的牛奶脂肪球表皮生长因子8(MFGE8)有关,这促进了凋亡人体的吞噬和细胞脱布的清除[6]。然而,在评估反应性星形胶质细胞对疾病进展的总体影响时,在保护稳态角色的潜在缺陷和有害功能的出现之外,至关重要的是,至关重要。最近的研究表明,反应性星形胶质细胞可能对神经元和内皮细胞产生净负面影响。从受prion感染的动物中分离出的反应性星形胶质细胞对原发性神经元表现出不利影响,导致树突状脊柱大小和密度降低以及突触完整性的损害[7](图1)。突触毒性作用是通过星形细胞分泌组的变化介导的,突出了信号传导途径在神经元功能障碍中的潜在作用。除了对神经元的影响外,反应性星形胶质细胞破坏了BBB的完整性。共培养实验涉及来自病毒感染的动物的星形胶质细胞或暴露于反应性星形胶质细胞的条件培养基中,诱导了从正常小鼠分离的内皮细胞中与疾病相关的表型[8](图1)(图1)。这种表型通过紧密和粘附连接蛋白的下调和异常定位以及内皮层的渗透性提高来征收这种表型。值得注意的是,星形胶质细胞激活程度和与prion疾病的孵育时间之间观察到非常强的反向相关[9]。具有快速疾病进展的动物群体表现出更严重的天线反应性,这表明星形胶质细胞的表型变化与缓解严重程度之间存在潜在的联系。这种观察结果提出了反应性星形胶质细胞的表型变化有助于更快的疾病进展的可能性。与这一假设一致,通过选择性靶向PERK信号传导的反应性星形胶质细胞中未折叠的蛋白反应的抑制作用,可以将其延长到小鼠中终末疾病的孵育时间[10]。总而言之,与Prion疾病相关的反应性星形胶质细胞对神经元和内皮细胞表现出有害的影响,并且可能是导致疾病进展的因素。阐明驱动星形胶质反应性的基本机制可能具有减轻与Prion疾病相关的神经退行性过程的治疗潜力。
引文 Licata JP, Gerstenhaber JA 和 Lelkes PI (2025) 用于体外电刺激心脏细胞的新型低成本生物反应器。前沿。生物
动脉、植入式设备(如起搏器或植入式除颤器),或在最极端的情况下移植整个心脏(Aronow,2009)。然而,这些疗法并不能直接修复心脏受损的组织。为此,人们进行了无数次尝试,将干细胞衍生的心肌细胞(CM)直接整合到梗塞的心脏中(Silver 等人,2021),无论是单细胞植入(Lee 等人,2024)还是实验室制造的心脏贴片(Liu 等人,2024)。迄今为止,仍然存在阻碍这些治疗成功的重大挑战,例如细胞保留(Wu 等人,2021 年)、由于干细胞分化不完全而导致的畸胎瘤形成风险(Kawamura 等人,2016 年)或缺乏电生理整合(Gepstein 等人,2010 年;Liao 等人,2010 年)。解决这些问题的一步是持续生成干细胞衍生的成熟 CM,这些 CM 在移植后可以通过连接蛋白电耦合到现有的心脏组织(Roell 等人,2007 年)并对电信号作出反应以控制心跳(Mandel 等人,2012 年)。电信号对于体内心脏组织的发育非常重要(Thomas 等人,2018 年;Hirota 等人,1985 年)。体外电刺激 (ES) 此前已被探索作为心脏细胞成熟和功能的调节剂,特别是在人类诱导多能干细胞衍生的 CM (hiPSC-CM) 中 (Ronaldson-Bouchard 等人,2019 年;Ma 等人,2018 年;Hernández 等人,2018 年)。然而,这些研究的结果并不一致。虽然大多数研究表明,一定量的直接耦合脉动 ES 有利于 CM 成熟,但尚未就最佳刺激参数达成共识,包括刺激信号的频率、幅度和脉冲持续时间 (Dai 等人,2021 年)。虽然大多数已发表的研究都是使用 3 – 6 V/cm 范围内的电场强度进行的(Ruan 等人,2016 年;Crestani 等人,2020 年;Chan 等人,2013 年),但其他研究报告称 ES 低至 2 V/cm(Hirt 等人,2014 年)或高达 9 V/cm(Ronaldson-Bouchard 等人,2018 年)。研究在 ES 信号的频率(Tandon 等人,2011 年)和持续时间(Geng 等人,2018 年;Yoshida 等人,2019 年)以及开始此类刺激的发育时间点(Crestani 等人,2020 年;LaBarge 等人,2019 年)方面也存在显著差异。个别研究可能会同时改变多个参数,例如:电刺激的幅度、脉冲频率、持续时间和发展时间。鉴于其中一些研究(Gabetti 等人,2023 年;Hu 等人,2024 年)报告了多个参数变化的结果,但没有适当的控制,因此很难区分哪些参数对于指导心脏分化至关重要。生物反应器是动态细胞和组织培养容器,用于为体外生长的细胞提供刺激,从而重现静态培养条件下通常找不到的环境线索(Licata 等人,2023 年)。尽管最近开发了生物反应器来向心脏细胞传递电信号,但作者往往未能提供足够的细节来确保工作可以重现(Gabetti 等人,2023 年;Hu 等人,2024 年)。在本研究中,我们提出了一种生物反应器,用于精确、可控的电刺激体外生长在 2D 单层或 3D 球体中的细胞。该生物反应器设计用于低剪切流体混合,以增强营养物质的利用率,同时还允许在整个实验期间使用