XiaoMi-AI文件搜索系统
World File Search System细菌CRISPR/CAS9系统作为所有健康问题的有希望的解决方案,并进步的生物工程
缩写:BP1,肿瘤抑制剂p53结合蛋白1; BRCA,乳腺癌抗原;汽车,嵌合抗原受体; CAS9,CRISPR相关蛋白9;级联,抗病毒防御的CRISPR综合体; CMR,CAS模块坡道(重复相关的神秘蛋白质); CMR III-B,多个亚基III型B CRISPR RNA-CAS蛋白; CPF1,Prevotella和Francisella1的CRISPR; CRISPR,定期间隔间隔室; Crrna,Crispr RNA; CSM III-A,多支亚基III-A CRISPR-CAS蛋白; dcas9/ sgrna-sg I,停用cas9/短指南RNA-Sybrr-green i; DNA-PK,DNA-蛋白K; DNA-PKC,DNA蛋白K催化亚基; DSB,双链断裂; ege,额外的基因元素; GRNA,导向RNA; HDR,同源性维修; IAP,碱性磷酸酶同工酶; MRE 11,减数分裂重组11; NHEJ,非同理结局加入; PAM,原始间隔者相邻基序; PD,程序性细胞死亡; RAD,重组酶A;代表,重复的外部回文; RPA,复制蛋白A; RT,逆转录酶; Sgrna,简短的指南RNA; SSB,单链断裂; tracrrna,反式激活CRISPR RNA; XLF,类似XRCC4的因子; XRCC 4,X射线修复交叉补充蛋白4; Yoyo-1,(恶唑黄色)
使用可充电海水电池同时存储和海水脱盐:可行性和未来方向
背景CRISPR-CAS系统通过各种高级基因组编辑工具(例如核酸酶,基础编辑器和转座酶)演变,这些工具可以有效地产生靶向靶诱变[1]。尤其是,基于CRISPR系统开发的胞嘧啶碱基编辑器(CBE)和腺嘌呤碱基编辑器(ABE)可以在包括小鼠在内的各种生物体中有效地执行C•g至t•a和a•t至g•c替代基础[2,3] [2,3] [4,5]。最近,也报道了C c cg base Editor(CGBE1),使C可以在人类细胞中进行G基础转移的c转移[6]。然而,由于基因编辑限制(由于同源性定向修复(HDR))导致的基因编辑局限性(HDR),涉及一个或多个核苷酸插入,转化或截断的精确靶向突变仍然具有挑战性。Prime Editor(PE)是一种新的概念基因组编辑工具,包括带有Nickase Cas9(H840A)的融合蛋白和商业的Moloney Moloney鼠白血病病毒逆转录酶(M-MLV RT)。pe由编码所需的编辑序列[7]的Prime编辑指南RNA(PEGRNA)驱动。这种精心设计的基因组编辑系统允许靶向基础转化率的靶向诱变,以及小的插入和插入,而没有双链DNA断裂或供体DNA [7-10]。
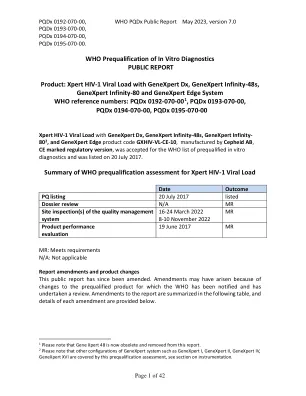
XPERT HIV-1病毒载量带有GenExpert DX,GenExpert Infinity-48s,GenExpert Infinity-80 2和GenExpert Edge产品代码GXHIV-VL-CE-10,Manufa
预期用途:根据Cepheid AB的主张,“ XPERT HIV-1 VL测定是一种体外逆转录酶聚合酶链反应(RT PCR)测定法,用于检测和量化人类免疫缺陷病毒1型(HIV-1)型 该测定法可以在40至10,000,000份/毫升的范围内量化HIV-1 RNA。 XPERT HIV-1 VL测定已验证用于从HIV-1组M(子类型A,B,C,C,D,F,G,H,H,J,K,C,CRF01_AE,CRF02_AG和CRF03_AB),N组N和组N和组N和组O。>该测定法可以在40至10,000,000份/毫升的范围内量化HIV-1 RNA。XPERT HIV-1 VL测定已验证用于从HIV-1组M(子类型A,B,C,C,D,F,G,H,H,J,K,C,CRF01_AE,CRF02_AG和CRF03_AB),N组N和组N和组N和组O。XPERT HIV-1 VL分析旨在与临床表现和其他实验室预后相结合,并用作通过血浆HIV-1 RNA水平的变化来评估对抗逆转录病毒治疗的病毒反应的帮助。该测定法旨在由实验室专业人员或特定培训的医护人员使用。
日本艾滋病毒感染者不良事件报告特征:日本艾滋病毒感染者不良事件数据挖掘
新型抗艾滋病毒药物的开发和抗逆转录病毒疗法 (ART) 方案的进步使得艾滋病毒感染者 (PLWH) 的治疗时间更长、更有效。然而,PLWH 的老龄化是另一个需要解决的问题。除了 ART 之外,许多 PLWH 还经常接受治疗各种合并症的药物治疗。然而,关于 PLWH 发生不良事件及其致病药物的真实世界数据很少。因此,本研究旨在阐明日本 PLWH 不良事件报告的特点。使用日本不良药物事件报告数据库 (JADER) 对发生不良事件的 PLWH 病例进行了全面搜索和分析。尽管指南推荐的 ART 方案有所变化,但在整个研究期间,抗 HIV 药物是 PLWH 不良事件的主要原因。然而,在 JADER 中注册为致病药物的抗 HIV 药物类别的报告率存在相当大的差异,尤其是主力药物。换言之,近年来整合酶链转移抑制剂的报告率有所增加,而蛋白酶抑制剂和非核苷逆转录酶抑制剂的报告率有所下降。免疫重建炎症综合征是报告最多的不良事件,并且经常被管理 HIV 感染患者的医疗保健提供者注意到。女性和老年患者的不良事件报告趋势与总体人群不同。这项研究可能提供有助于制定艾滋病毒感染者最佳管理策略的见解。
基于CRISPR的猪功能基因组学和核酸检测研究进展
靶向核酸酶等高精度基因组编辑工具的发展加速了人类基础医学、动物科学、动物育种以及疾病诊断等领域的进步(Doudna and Charpentier,2014;Kurtz 等,2021;Rieblinger 等,2021;Xie 等,2021)。尤其是被称为 CRISPR 技术的基因组编辑系统自首次报道以来发展迅速(Jinek 等,2012),成为最热门的技术之一。CRISPR/Cas9 技术可精准识别靶序列并实现高效的 DNA 切割,从而完成全基因组范围的基因敲除/敲入(Cong 等,2013;Koike-Yusa 等,2014)。但由于编辑过程中会发生双链断裂(DSB),该技术往往会引入大量不理想的InDel(插入和缺失)突变(Zhao et al.,2019)。随后,人们开发了碱基编辑器(BE),可以利用胞嘧啶脱氨酶或腺苷脱氨酶实现单核苷酸的精准编辑,而不会诱导DSB(Gaudelli et al.,2017;Rees and Liu,2018)。近来,引物编辑器(PE)进一步扩展了基于CRISPR的编辑工具包,可实现所有12种可能的碱基转换和短DNA片段的插入和缺失。该技术融合逆转录酶和Cas9蛋白,以引物编辑向导RNA(pegRNA)为修复模板,实现精准的基因编辑(Anzalone et al.,2019)。在这篇小型评论中,我们总结并讨论了 CRISPR 技术在猪中的最新应用。
验证田园基因缩写测定法以检测融合并遇到非小细胞肺癌中的外显子孔
idylla™平台在欧洲符合2017/746年欧盟IVD规定的CE标记,该法规在美国出售,并在许多其他国家进行了注册。idylla™基因输入测定法仅用于研究用途(RUO),而不是用于诊断程序。该产品包含superscript™III逆转录酶,并根据由Life Technologies Corporation拥有或许可的专利或专利申请提供了许可,该公司的许可仅限于人类诊断领域和研究领域,并专门排除在法医学(包括人类认同测试)中的应用。SuperScript™III商标归Life Technologies Corporation拥有。专利美国7,700,339,8,168,383,8,481,279,8,486,645,8,232,060,8,288,102,8,3777,642,9,988,688,9,523,688,9,523,130,130,9,66,130,9,96,85555 9,364,477、9,539,254、10,551,383,并在US申请及其所有各自的外国等价物中获得了Cell Signaling Technology,Inc.。该外部出版物中提供的数据和结论是由第三方在外部得出的,在开发idylla™GeneFusion测定法中尚未得到验证,也没有由Biocartis NV的当前标记中包含。Biocartis NV产品设计为使用特定于产品的使用(IFU)中所述。idylla™可在欧洲,美国和许多其他国家 /地区出售。请与Biocartis代表一起检查可用性。Biocartis和Idylla™是欧洲,美国和许多其他国家的注册商标。Biocartis拥有的Biocartis和Idylla™商标和徽标是使用的。保留所有权利©2024年1月,Biocartis NV。
2025 年 1 月卫生技术简报
多拉韦林-伊拉曲韦正在开发中,用于治疗未接受过治疗(治疗初治)的人类免疫缺陷病毒 1 (HIV-1)。HIV-1 是一种攻击免疫系统细胞的病毒。HIV-1 对免疫系统造成的损害会导致获得性免疫缺陷综合征 (AIDS),这是一种慢性且可能危及生命的疾病。艾滋病的症状包括体重减轻、慢性腹泻、盗汗、发烧、持续咳嗽、口腔和皮肤问题、经常感染和严重疾病。目前,针对未接受治疗的 HIV-1 患者的治疗方案通常包括多种口服药片,这可能很复杂并且与治疗依从性差有关。多拉韦林和伊拉曲韦抑制逆转录酶 (RT),这是一种允许 HIV-1 复制的酶。这些技术通过不同的机制抑制 RT,从而降低了 HIV-1 对组合产生耐药性的可能性。先前的试验发现,多拉韦林-伊拉曲韦与用于控制 HIV 的其他药物组合一样有效。多拉韦林-伊拉曲韦 (100 毫克/0.25 毫克) 每天口服一次,与服用多片口服药相比,这可能会提高治疗依从性。如果获得许可,多拉韦林-伊拉曲韦将为未接受治疗的 HIV-1 患者提供额外的治疗选择。
TERT表达与薄薄的初步转移,黑色素瘤中疲惫的CD4+ T细胞以及跨癌症实体的DNA修复
端粒酶逆转录酶(TERT)启动子突变经常发生在癌症中,与TERT表达和细胞增殖增加有关,并可能影响黑色素瘤的治疗方案。作为TERT表达在恶性黑色素瘤中的作用和TERT的非规范功能,我们的目的是通过分析几个高度注释的高度注释的黑色素瘤队列来扩展当前对TERT启动子突变和肿瘤进展中表达改变的知识。使用多元模型,我们发现在免疫检查点抑制下,没有用于TERT促进突变突变或TERT表达与黑色素瘤同龄人的存活率的稳定关联。然而,CD4+ T细胞的存在随TERT表达而增加,并且与耗尽标记的表达相关。虽然启动子突变的频率没有随着勃斯洛的厚度而变化,但在较薄的原始引起的转移中,TERT表达增加了。作为单细胞RNA - 序列(RNA-Seq)表明,TERT表达与细胞迁移的基因和细胞外基质的动力学有关,这表明TERT在侵袭和转移过程中的作用。在几个大肿瘤和单细胞RNA-seq队列中发现的共同调节基因也表明,与线粒体DNA稳定性和核DNA修复有关的TERT的非传统功能。这种模式在胶质母细胞瘤和其他实体中也很明显。因此,我们的研究增加了TERT表达在癌症转移中的作用,并可能具有免疫抵抗力。
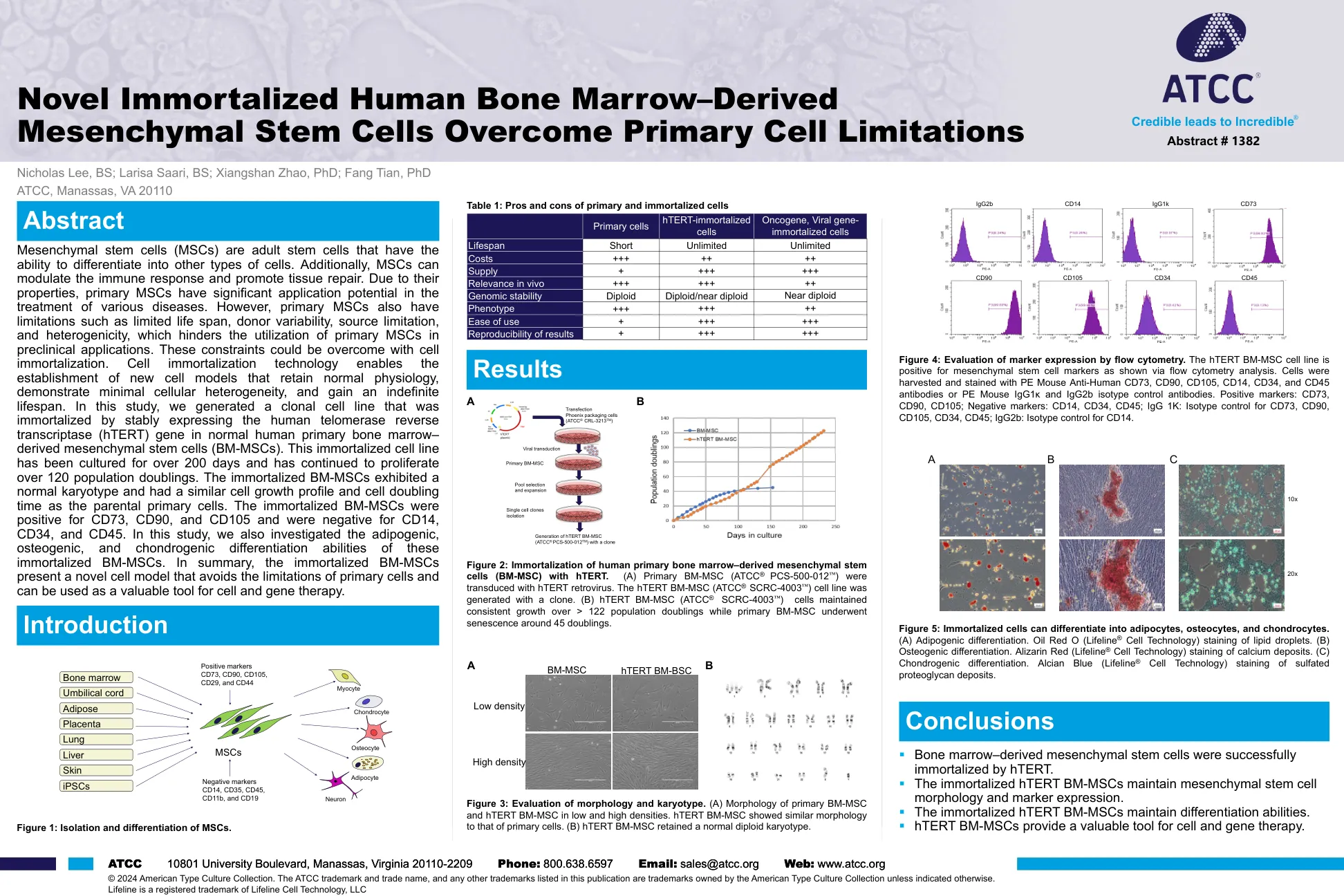
间充质干细胞(MSC)是具有分化为其他类型细胞的成年干细胞。此外,MSC可以调节T
间充质干细胞(MSC)是具有分化为其他类型细胞的成年干细胞。此外,MSC可以调节免疫反应并促进组织修复。由于其性质,主要MSC在治疗各种疾病方面具有显着的应用潜力。然而,主要MSC还具有限制寿命,供体变异性,源限制和异质性等局限性,这阻碍了临床前应用中主要MSC的利用。这些约束可以通过永生化来克服。细胞永生技术可以建立保留正常生理学的新细胞模型,表现出最小的细胞异质性并获得不确定的寿命。在这项研究中,我们通过稳定表达人端粒酶逆转录酶(HTERT)基因在正常的人类原发性骨髓 - 衍生的间充质干细胞(BM-MSC)中产生了一个永生的克隆细胞系。这种永生的细胞系已培养超过200天,并继续繁殖超过120个人口加倍。永生的BM-MSC表现出正常的核型,并且与父母原代细胞具有相似的细胞生长曲线和细胞的两倍时间。永生的BM-MSC对CD73,CD90和CD105呈阳性,对于CD14,CD34和CD45为阴性。在这项研究中,我们还研究了这些永生的BM-MSC的脂肪生成,成骨和软骨分化能力。总而言之,永生的BM-MSC提出了一种新的细胞模型,该模型避免了原代细胞的局限性,可以用作细胞和基因治疗的有价值的工具。
非双重遗传病的基因组编辑......
《自然》杂志上发表的一篇文章( Anzalone 等人,2019 年)报道了一种基因组编辑实验方法的开发,该方法无需双链断裂 (DSB) 或供体 DNA (dDNA) 模板,即可介导人类基因组中所有可能的碱基到碱基的转换、“插入/缺失”和组合。Prime 编辑是一种新颖的基因组编辑方法,它利用一种比平常更长的单向导 RNA (gRNA),称为 Prime 编辑 gRNA (pegRNA),以及一种由 Cas9 H840A 切口酶与工程逆转录酶 (RT) 融合而成的融合蛋白。Prime 编辑被描述为“搜索和替换”碱基编辑技术,它在 gRNA 的延伸中提供所需的遗传构建体,然后使用 RT 酶将其转化为 DNA。与传统的 CRISPR-Cas 设备相比,新方法无需同时递送校正 DNA 模板,可执行所有可能的核苷酸替换(包括针对相当一部分遗传疾病的替换),解决插入/缺失引起的移码问题,并减少脱靶编辑。Prime 编辑是对现有 CRISPR 编辑系统的一个令人兴奋的新补充,在许多情况下甚至可能是一种改进。然而,Prime 编辑带来了新的挑战。克服这些障碍并在体内应用 Prime 编辑,将带来针对罕见遗传疾病的新型基因组编辑疗法。