机构名称:
¥ 1.0
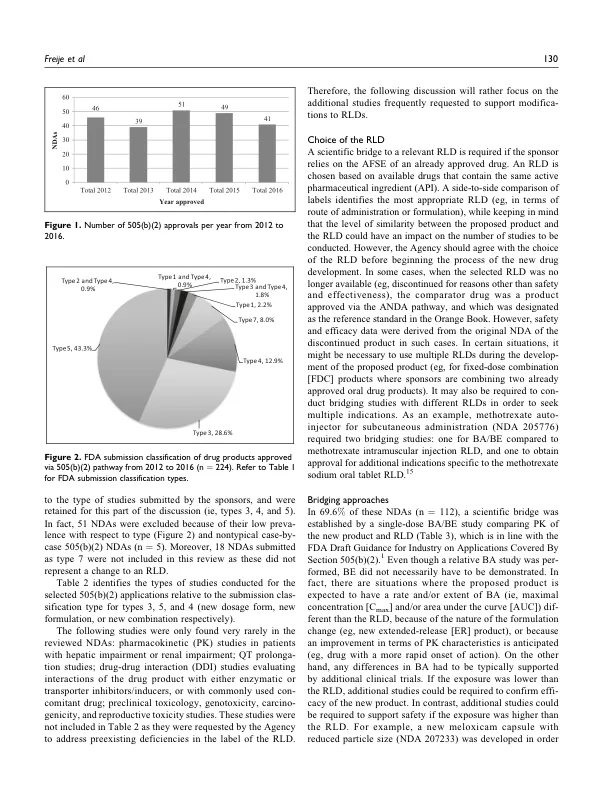
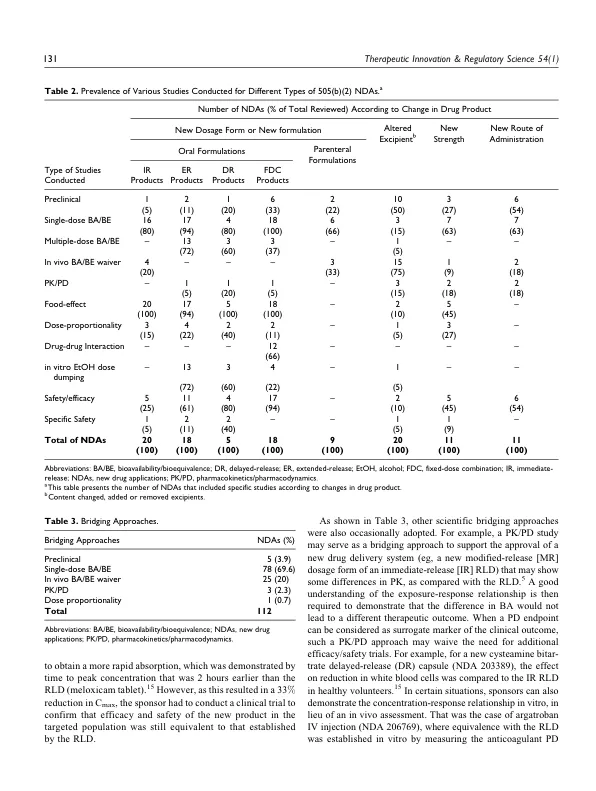
摘要 505(b)(2) 申请是美国新药申请 (NDA) 的一种,其中包含安全性和有效性调查的完整报告,但其中至少部分批准所需的信息来自非申请人开展或为申请人开展的研究,且申请人未获得参考权。大多数 505(b)(2) 申请都涉及对之前批准的药品的更改(即新剂型、新给药途径等)。申办方在确定通过 505(b)(2) 途径支持批准所要开展的研究时经常面临挑战。这项为期 5 年(2012-2016 年)的回顾性分析审查了 FDA 网站上已批准的 505(b)(2) NDA,以确定针对各种类型提交进行的研究性质(临床前、临床药理学和功效/安全性),并更好地了解监管要求方面的趋势。数据库包含 226 个 NDA。在这 226 份 NDA 中,有 112 份具有完整的 FDA 审查信息,其中以下 FDA 提交类别更为普遍:类型 3,新剂型;类型 4,新组合;类型 5,新配方或新制造商。因此,仅对这 112 份 NDA 进行了进一步研究,因为它们可以显示针对各种申请进行的研究趋势。基于对 NDA 审查文件的调查,结合指导文件,我们开发了要进行的研究的决策树,这些决策树可作为成功的 505(b)(2) 开发计划和 NDA 提交的建议指南。
通过 505(b)(2) 途径批准的药物的审查