机构名称:
¥ 2.0
人类糖蛋白 α-1-抗胰蛋白酶 (AAT) 是一种丝氨酸蛋白酶抑制剂,其病理变体会错误折叠并形成自缔合聚合物,与 AAT 缺乏症有关。生化分析表明,AAT 在核糖体翻译过程中自然停滞,并形成强制性压缩中间体,该中间体在翻译后完成折叠,但在存在 Z 突变时容易发生错误折叠 (1)。在本项目中,我们旨在使用 19F NMR 光谱法表征核糖体上 AAT 中间体的结构。目前,19F NMR 是唯一能够直接观察共翻译折叠中间体的实验技术 (2),而位点特异性标记允许分别通过化学位移分析和顺磁弛豫增强测量获取短程和长程结构信息。
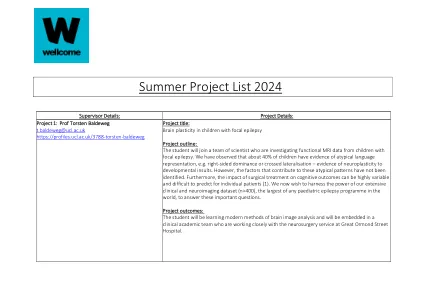
2024 年夏季项目清单