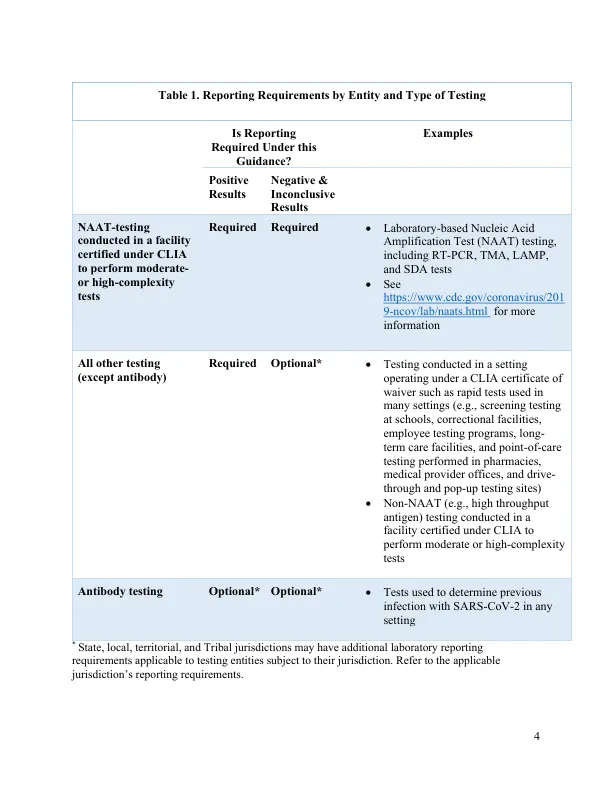
COVID-19 疫情应对,实验室数据报告:CARES 法案第 18115 节 2022 年 3 月 8 日 生效日期:2022 年 4 月 4 日 介绍性信息 公法 116-136,§ 18115(a),冠状病毒援助、救济和经济安全 (CARES) 法案,要求“每个执行或分析旨在检测 SARS-CoV-2 或诊断可能的 COVID-19 病例的测试的实验室”将每项此类测试的结果报告给卫生和公众服务部 (HHS) 部长。该法规授权部长规定此类报告的形式和方式以及时间和频率。本更新指南概述了根据本法律授权向 HHS 提交数据的要求。为了以最有效的方式接收这些数据,部长要求通过现有的公共卫生数据报告方法报告数据元素,即通过向本指南中所述的州、领土、地方和部落 (STLT) 公共卫生部门报告。作为一项指导原则,必须使用现有的报告渠道将数据发送到 STLT 卫生部门,以确保这些部门迅速做出公共卫生反应(根据 STLT 法律、政策和程序)。此报告应与与订购提供者或患者共享测试结果同时进行(如适用)。HHS 承认报告实验室依赖于他们从订购医疗保健提供者那里获得的患者样本信息,因为实验室通常不与患者互动。为了实现 § 18115(a) 的目的,HHS 强烈鼓励订购提供者收集所需的数据元素并将其传输到有测试订单的实验室。本指南概述了《CARES 法案》第 18115 条规定的联邦 HHS 实验室报告要求;STLT 管辖区可能对其管辖范围内的检测实体有额外的实验室报告要求。本指南第 A 部分第 2 节要求实验室和检测实体遵守适用的 STLT 检测报告要求。本指南中的任何内容均不限制或禁止 STLT 卫生部门请求或要求额外的 SARS-CoV-2 结果和/或数据元素报告。本指南的 A 部分规定:• 实验室报告要求,包括实体和检测类型的报告要求(第 1 节);• STLT 卫生部门要求的报告结果(第 2 节);• 提交的时间、频率和方法(第 3 节);• 所需的最低数据元素(第 4 节);• 数据报告和传输要求(第 5 节);以及• 实验室报告和电子健康记录指南(第 6 节)。