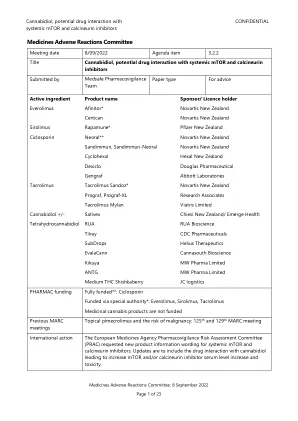
XiaoMi-AI文件搜索系统
World File Search System疫苗的不良反应和副作用
– 布莱顿合作组织制定了疫苗接种后不良事件的标准化定义 [1]。 – 疫苗不良反应报告系统(VAERS)是一种从多个来源报告严重不良反应的被动监测系统[2]。 – 疫苗数据链接(VSD)是美国疾病预防控制中心的一个主动监测系统,该系统与 8 家美国私人医疗保健组织(管理式医疗组织)合作,对罕见的疫苗接种后副作用进行主动和持续的监测(通过快速周期性分析每周更新监测数据)。 - CISA(临床免疫安全评估)旨在制定评估和管理不良反应的协议 [3]。 - 美国国家医学院(前身为医学研究所)的免疫安全审查委员会负责建立不良事件与疫苗之间的因果关系 [4]。
严重皮肤不良反应 (SCAR)
可用于或施用于人类,目的是通过发挥药理、免疫或代谢作用来恢复、纠正或改变生理功能,或用于进行医学诊断。注:在其他司法管辖区,这可能被称为药品、医疗产品或药物,可能包括生物制品和疫苗。
牛痘疫苗相关不良反应
牛痘疫苗相关不良反应 牛痘病毒属于正痘病毒属,经过基因改造可用作天花疫苗的病原体 1–3 。天花疫苗是一种活病毒疫苗,一般只推荐用于感染风险极高的人,例如接触过天花病毒的人 1 。免疫功能低下者、湿疹或其他皮炎患者及孕妇禁用该疫苗 1–3 。牛痘疫苗对预防天花非常有效,但接种第一剂后 5 至 10 年免疫力会下降 1,2 。A. 病原体:牛痘病毒(天花疫苗)1–3 B. 临床描述:大多数人对天花疫苗的反应都是正常的,通常是轻微的。这些反应包括手臂酸痛、发烧、腺体肿胀和身体疼痛 2,3 。还可能发生其他更严重的反应,需要报告。弥漫性皮肤并发症 2,3 :
疫苗接种不良反应指南
毫无疑问,疫苗接种是预防传染病最有效的措施之一。然而,与其他生物制品一样,疫苗相关不良事件 (VAAE),包括猫注射部位肉瘤 (FISS) 也可能发生 (Day, 2006; Day 等人, 2016; Hartmann 等人, 2023)。尽管人们认为这些情况很少见,但了解它们可能发生的可能性是主人在决定是否接种疫苗时知情同意的重要部分 (Day 等人, 2016; Stone 等人, 2020)。最大的困难是获取接种疫苗数月或数年后出现的 VAAE 的数据。相比之下,接种疫苗后不久(例如几天内)和/或在注射部位发生的 VAAE 更容易识别。尽管所有动物物种中 VAAE 可能都被低估了,但狗和猫中 VAAE 的报告频率高于其他动物(Gaskell 等人,2002 年;Zaugg 和 Ottiger,2021 年)。
肺癌患者的皮肤不良反应...
摘要。抗皮肤生长因子受体(EGFR)靶向疗法在过去几年中进行了深入研究,这是出于富含HER2-增强的乳腺癌(BC)患者的单克隆抗体获得的有利结果。抗EGFR药物的大多数研究替代方法是酪氨酸激酶抑制剂(TKI)和单克隆抗体。然而,由于缺乏特异性和频繁的不良副作用,剩下的抗EGFR分子不包括剩下的抗EGFR分子的曲曲霉和pertuzumab。tkis具有多个优点,包括降低心脏毒性,口服施用以及对脑转移性BC的血液屏障的良好渗透。lapatinib和neratinib以及最近的瓜托尼(仅在中国批准)是多年来研究的数十个分子的TKI,被批准为
抗癌药物的皮肤科不良反应
Mathilde Strumia、Marie-Loup Perrin、Emilie Patras de Compaigno、Cécile Conte、Francois Montastruc 等人。抗癌药物的皮肤病不良反应:药物警戒的国际数据。治疗学,2022,77(2),第219-227页。 “10.1016/j.therap.2021.12.006”。 �hal-04357786�
抗 SARS-CoV-2 疫苗的不良反应
摘要:迄今为止,冠状病毒病 (COVID-19) 已在世界范围内造成高发病率和死亡率。为了应对大流行,开发并测试了几种针对严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 病因的疫苗。截至 2020 年 12 月底,BNT162b2 (Comirnaty,辉瑞-BioNTech) 是意大利首个也是唯一一个获准用于特定类别的疫苗,例如医护人员、体质虚弱的患者和 80 岁以上的人群。为了掌握有关 BNT162b2 不良反应 (AR) 的知识,我们针对在巴勒莫大学医院 COVID-19 疫苗接种中心接种过疫苗的自愿参与者建立了基于即时消息的主动监测系统。总体而言,本研究纳入了 293 名接种疫苗的人,其中以医护人员较多(n = 207,70.6%,中位年龄为 36 岁,IQR = 29–55),其次是健康专业学生(n = 31,10.6%,中位年龄为 27 岁,IQR = 25–29),报告至少一次局部或全身 AR 的比例为 82.6%。具体来说,第二剂 Comirnaty 后至少一次局部或全身 AR 的频率(n = 235,80.2%)与第一剂相比具有更高的统计学意义(n = 149,50.9%;p < 0.001)。然而,第二剂后的局部疼痛、肿胀、关节痛和肌肉痛是导致工作受限的症状,具有统计学意义。最年轻的人患局部或全身性 AR 的风险较高(aOR = 7.5,CI 95% = 2.9–18.9),而女性患全身性 AR 的风险较高(aOR = 1.8,CI 95% = 1.1–3.0)。尽管检查的样本很小,但这种通过即时通讯进行的主动监测系统似乎比被动监测获得的数据检测到更高的 AR 患病率。可能需要进一步研究以优化这种临床监测,这可以被视为一种有效且及时的主动监测。
抗癌药物不良反应模式
摘要简介:抗癌药物是全球药物不良反应 (ADR) 负担中的重要一环。任何量化其严重程度并提供最新知识的尝试都将有助于肿瘤学家开出更安全的处方。目的:这项观察性随访研究针对接受抗癌治疗的新诊断癌症患者进行,旨在确定 ADR 的频率、严重程度、因果关系、可预测性和可预防性。受试者和方法:对患者进行 6 个月的随访,以了解不良事件的发生情况。使用 IBM SPSS Statistics for Windows,版本 22.0。(纽约州阿蒙克)分析数据,并以描述性统计的形式呈现。结果:每位患者平均被开具约 6.85 ± 1.51(平均值 ± 标准误差)种药物。所有接受抗癌化疗的患者(100%)均出现 ADR。脱发、恶心呕吐、灼热刺痛和麻木是最常见的 ADR。女性脱发 ( P < 0.0004)、恶心 ( P < 0.03) 和口腔溃疡 ( P < 0.02) 的发生率较高。最高反应为 2 级 (69.53%)。大多数反应 (75.80%) 出现在接受第一个周期的 10 天内。99.58% 的反应并不严重。根据世界卫生组织 - 乌普萨拉监测中心的标准,99.47% 的 ADR 属于可能类别。根据 Naranjo 算法,100% 的 ADR 属于很可能类别。大约 94.80% 的反应被发现是可预测的。大约 56.47% 的反应可能是可以预防的,43.53% 的反应是无法预防的。结论:在新诊断的癌症患者中出现了多种 ADR。其中大多数是可预测的、严重程度轻度至中度的、不严重的且可以预防的。大多数 ADR 会随着时间的推移而恢复。