XiaoMi-AI文件搜索系统
World File Search System成人接种乙肝疫苗的常规医嘱
无论疫苗接种情况如何,都应进行血清学检测。还建议对感染风险较高的易感人群进行定期检测。应继续接种疫苗,如果无法进行筛查检测或在有机会接种疫苗时拒绝进行筛查检测,则不应推迟接种疫苗。理想情况下,血清学检测可以在接种疫苗的同一次就诊中进行,第一剂疫苗在抽血后注射。如果发现患者为 HBsAg 阳性,应提供适当的医疗随访;如果患者为 HBsAg 阳性或有证据表明对 HBV 具有免疫力(定性报告为“阳性”或量化至少为 10 IU/mL),则无需进一步接种乙肝疫苗。有关详细信息,请参阅 2023 年 CDC 筛查建议,网址为 www.cdc.gov/mmwr/volumes/72/rr/pdfs/rr7201a1-H.pdf。
乙肝疫苗
什么是乙肝疫苗? 乙肝疫苗可预防引起肝脏问题的乙肝病毒感染。 乙肝疫苗有哪些好处? 乙肝疫苗是一种安全有效的方法,可保护您自己免受乙肝感染及其严重并发症(包括慢性肝病、肝癌和肝功能衰竭)的侵害。 通过接种疫苗,您还可以帮助减少病毒向周围人的传播。 如何接种疫苗? 疫苗以注射方式注射到大龄儿童和成人的上臂和婴儿的大腿。 谁应该接种乙肝疫苗? 乙肝疫苗是新不伦瑞克省常规免疫计划的一部分,以三剂计划提供给所有婴儿和儿童。 通过与乙肝感染者密切接触而接触到病毒的个人也可以接种该疫苗。 患有特定健康状况或情况而更容易感染乙肝的个人也可以接种该疫苗。虽然没有通过公共卫生免疫计划资助,但建议以下人群接种乙肝疫苗。疫苗可以在旅行诊所或当地药房购买:
将乙肝出生剂量疫苗引入塞内加尔国家免疫计划的成本(NéoVac 研究)
1 艾克斯马赛大学,INSERM,IRD,SESSTIM,健康与医学信息处理经济与社会科学,ISSPAM,13385 马赛,法国; andrea.gosset@inserm.fr(AG); marie.nishimwe@inserm.fr(MLN); mayadiallo2008@yahoo.fr(马来西亚); pmcarrieri@aol.com (PMC) 2 巴斯德研究所新发疾病流行病学组,75015 巴黎,法国; lucas.deroo@hec.ca (LD); muriel.vray@pasteur.fr(MV); yusuke.shimakawa@pasteur.fr (YS)3 VITROME,媒介-热带和地中海感染,IRD-UCAD 汉恩校区,达喀尔 CP 18524,塞内加尔; aldiouma.diallo@ird.fr(广告); el-hadj.ba@ird.fr(欧洲卫生局); Cheikh.Sokhna@ird.fr (CS) 4 VITROME,Aix Marseille Univ,IRD,SSAS,IHU-MI,AP-HM,13385 马赛,法国 5 巴斯德研究所传染病流行病学部,达喀尔 BP 220,塞内加尔 6 INSERM,75013 巴黎,法国 * 通信地址:sylvie.boyer@inserm.fr;电话:+33-41-373-2272
慢性乙肝病毒感染患者极低病毒血症的临床 ...
社会将这些患者分为低水平病毒血症(LLV)患者和极低水平病毒血症(VLLV)患者。对于LLV,国内外均有报道,而对于VLLV,国际上讨论较少。目的 确定常规PCR检测乙肝病毒感染阴性的VLLV患者比例,分析VLLV的临床特点及相关因素,为临床工作中VLLV的防治提供依据。方法 选取2020年10月至2021年3月解放军总医院第五医学中心确诊的998例HBV感染患者,其HBV DNA低于40 IU/mL,采用高敏HBV DNA技术检测患者血清病毒载量,根据检测结果将患者分为VLLV组(5~40 IU/mL)和HBV DNA阴性组(<5 IU/mL)。比较两组患者的血常规、生化、HBV标志物及影像学检查情况,采用logistic回归分析VLLV的影响因素,并将VLLV组又分为HBV DNA≥20 IU/mL组和HBV DNA<20 IU/mL组,分析两组患者临床资料的差异。 VLLV组HBsAg定量(M[IQR]:2 781.00[2 540.00~4 785.00]vs 604.00[67.51~870.00],P< 0.001)、AFP(2.68[1.74~3.80]vs 2.30[1.66~3.32],P=0.020)及HBeAg阳性率(39.13%vs 23.22%、P=0.001)均高于HBV DNA阴性组;VLLV组慢性肝损害比例高于HBV DNA阴性组(70.00%vs 59.51%、P=0.042)。 VLLV与病情分期、是否用药、HBsAg定量、AST、ALT等均有关(P<0.05),其中HBsAg定量(OR=7.684,95%CI:3.289~17.950)与VLLV独立相关。亚组分析显示,病毒载量与病情分期、是否用药、用药时间、HBsAg定量、AST、ALT等均无明显相关性(P>0.05)。结论 HBsAg定量高的患者发生VLLV的概率较大,临床应加强对此类患者的监测。
老挝人民民主共和国医护人员乙肝病毒暴露、血清保护状况及易感性:横断面研究
1 LaoLuxLab/疫苗可预防疾病实验室,老挝巴斯德研究所,Ban Kao-gnot,万象,老挝人民民主共和国 2 老挝热带和公共卫生研究所,卫生部,万象,老挝人民民主共和国 3 老挝卫生部卫生科学大学研究与教育发展研究所,万象,老挝人民民主共和国 4 老挝-牛津-玛霍索医院-威康信托研究单位 (LOMWRU),微生物实验室,玛霍索医院,万象,老挝人民民主共和国 5 牛津大学纳菲尔德医学系热带医学和全球健康中心,英国牛津 6 新加坡国立大学苏瑞福公共卫生学院,新加坡 7 卢森堡卫生研究所感染与免疫系,卢森堡 8 威斯敏斯特大学生命科学学院,英国伦敦 *这些作者的贡献相同
乙肝 TDaP MMR 水痘 结核病 流感疫苗...
豁免 如果学生由于医疗原因无法接种疫苗,他们必须与项目协调员讨论医疗豁免并提供医生证明。如果临床机构批准医疗豁免,则必须向免疫和医疗记录办公室提交文件。我们还强烈建议这些学生进行血液测试以证明可能具有免疫力。医疗豁免和拒绝都必须每年在适当的表格上更新。如果学生由于免疫要求而无法完成临床,那么他/她/他们就无法完成课程。 药物筛查 请注意,实习附属机构可能会要求学生接受并通过药物筛查分析才能获得资格。未能通过或拒绝接受药物筛查分析的学生将被视为没有资格进行临床实习,这将影响他们在项目中的地位。 不遵守规定 学生在未完全满足所有健康要求的情况下将不允许参加临床体验。请将要求提交至:护理、卫生与保健免疫和医疗记录办公室霍桑大厦 - 办公室 #323 伯克希尔社区学院主校区电话:413-236-4609 传真:800-724-9943 medicalrecords@berkshirecc.edu
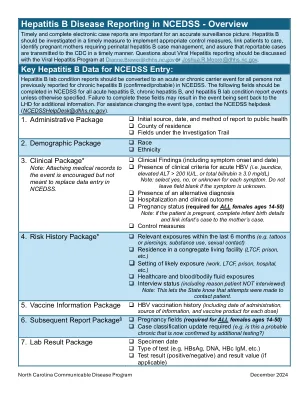
NCEDSS 中的乙肝疾病报告 - 概述
对于 NCEDSS 中之前未报告慢性乙型肝炎(确诊/可能)的所有人员,乙型肝炎实验室状况报告应转换为急性或慢性携带者事件。除非另有规定,否则应在 NCEDSS 中填写所有急性乙型肝炎、慢性乙型肝炎和乙型肝炎实验室状况报告事件的以下字段。未填写这些字段可能会导致事件被送回 LHD 以获取更多信息。如需更改事件类型的帮助,请联系 NCEDSS 帮助台 (NCEDSSHelpDesk@dhhs.nc.gov)。1. 管理包 向公共卫生部门报告的初始来源、日期和方法 居住县 调查线索下的字段
19-59 岁成人普遍接种乙肝疫苗的最新建议——美国,2024 年
2024 年 9 月 11 日,食品药品管理局批准了一项请求,更新 Heplisav-B 疫苗标签,增加适用于孕妇的新适应症(3、4)。一项上市后观察性回顾性队列研究 (DV2-HBV-28)* 纳入了 75 例已知结果的妊娠,其中 10 例在受孕前 28 天至妊娠结束期间接受过两次 Heplisav-B 治疗。在 75 名怀孕前或怀孕期间接触过 Heplisav-B 的孕妇中,44 人在受孕前 28 天接受过 Heplisav-B 治疗,24 人在妊娠前三个月接受过 Heplisav-B 治疗,6 人在妊娠中期接受过 Heplisav-B 治疗,1 人在妊娠晚期接受过治疗。未发现重大出生缺陷,流产风险低于估计的背景风险。这些可用数据主要针对在受孕前 28 天或怀孕期间接受过 1 剂 Heplisav-B 的人,并不表明重大出生缺陷和流产的风险增加。美国食品药品管理局根据《公共卫生服务法》第 351(a) 条 † 批准重组佐剂型乙肝疫苗 (HEPLISAV-B),更新包装说明书以包括来自研究 DV2-HBV-28 的数据,允许使用 Heplisav-B 为需要接种乙肝疫苗的孕妇接种疫苗 ( 3 , 4 )。
表 4 – 乙肝暴露后预防
乙肝疫苗在接触病毒后 7 天内接种(最好在 48 小时内接种)可有效预防急性感染。乙肝免疫球蛋白 (HBIG) 仅适用于已知来源为 HBsAg 阳性,或已知接种者对 HBV 疫苗无反应且已知来源为高风险的情况。如有需要,HBV 疫苗/HBIG 最好在接触病毒后 48 小时内接种,但不得晚于 7 天。有关 HBV 疫苗的建议,请参阅 NIAC 指南第 9 章。接种者 HBV 疫苗接种状态
乙肝疫苗:高风险客户订购表
个人健康信息的收集、使用和披露均受《健康保护和促进法》 RSO 1990 cH7 第 5 节及其条例的授权。收集这些信息的目的是评估、规划、记录维护、评估和报告达勒姆地区卫生部需要提供的支持服务水平,例如减少或消除疫苗可预防疾病,以及为儿童和成人提供疫苗服务。有关此类信息收集的问题,请联系达勒姆地区卫生部健康信息、隐私和安全经理,地址:605 Rossland Rd E., PO Box 730, Whitby, ON, L1N 0B2,电话:(905) 668-7711。