XiaoMi-AI文件搜索系统
World File Search SystemP-WLCSP 先进封装助力下一代医疗设备应用
• FEOL 采用现成的代工工艺制造集成电路 • BEOL 采用 SoP 制造,具有超薄、灵活和背面功能 • 包括精密电阻器、电容器、电感器 • 能够包含灵活的光子硅波导(美国专利 9,733,428) • 堆叠金属层之间的高密度互连 • 精确的尺寸公差简化了 IC 键合和连接 • 半导体材料与硅 IC 的 CTE 相匹配 • 顶部和底部表面均具有高密度互连
2023年7月28日,Mesi,医疗设备有限公司的开发
Trade/Device Name: MESI mTablet ECG Diagnostic System, MESI mTablet ECG Regulation Number: 21 CFR 870.2340 Regulation Name: Electrocardiograph Regulatory Class: Class II Product Code: DPS Dated: June 23, 2023 Received: June 27, 2023 Dear Elaine Duncan: We have reviewed your Section 510(k) premarket notification of intent to market the device referenced above并已经确定该设备在1976年5月28日之前在州际贸易中销售的法律上市的谓词设备(在1976年5月28日,《医疗设备修正案》的颁布日期,或已根据批准的批准(ACT ACT)批准的规定(ACT ACT)进行的一项批准的设备(均不针对批准)重新分类的设备。因此,您可能会销售该设备,但要遵守该法案的一般控制条款。尽管这封信将您的产品称为设备,但请注意,一些清除的产品可能是组合产品。位于https://www.accessdata.fda.gov/scripts/cdrh/cdrh/cfdocs/cfpmn/pmn.cfm上的510(k)上市通知数据库。该法案的一般控制条款包括年度注册,设备上市,良好的制造实践,标签和禁止品牌和掺假的禁令。请注意:CDRH不评估与合同责任保证有关的信息。我们提醒您,设备标签必须是真实的,不要误导。此外,FDA可能会在联邦登记册中发布有关您的设备的进一步公告。如果您的设备被分类(请参见上文)为II类(特殊控件)或III类(PMA),则可能会受到其他控件的约束。可以在《联邦法规》第21章,第800至898部分中找到影响您设备的现有主要法规。请注意,FDA发布实质性的确定并不意味着FDA已确定您的设备符合该法案的其他要求或任何联邦政府的要求
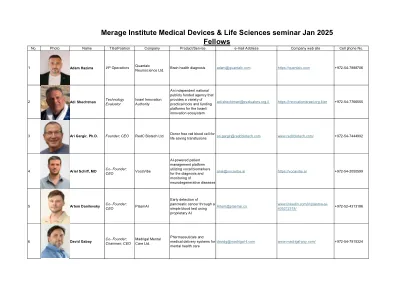
Merage Institute医疗设备与生命科学研讨会2025年1月
11 Shai Elbaz博士联合创始人;首席执行官Spinodal Ltd. 破坏性手术机器人导航技术11 Shai Elbaz博士联合创始人;首席执行官Spinodal Ltd.破坏性手术机器人导航技术
医疗设备中的网络安全:质量系统的注意事项和内容的内容
前言公众评论,您可以随时提交电子评论和建议,以供代理商考虑到https://www.regulations.gov。向码头管理人员提交书面评论,食品和药物管理局,5630 Fishers Lane,1061室(HFA-305),Rockville,MD 20852。用案卷编号FDA-2021-D-1158确定所有注释。在下一个文档进行修订或更新文件之前,该机构不得采取评论。其他副本CDRH可从Internet获得其他副本。您还可以将电子邮件请求发送到cdrh-guidance@fda.hhs.gov,以接收指南的副本。请在请求中包含文档编号GUI00001825和指南的完整标题。cber可以从生物制度评估与研究中心(CBER),通信,外展与发展办公室(OCOD)(OCOD),10903 New Hampshire Ave.,WO71,3128室,Silver Spring,MD 20903,或致电1-800-800-800-835-4709或2409或240-40-402-802-G.从互联网上的https://www.fda.gov/vaccines-blood-biologics/guidance-compliance-neforation-information-information-biologics/biologics-guidances
GAO-24-106699,医疗设备:FDA已开始建立一个主动的后市场监视系统
b FDA预计将在2024年12月之前完成第一年的扩展,取决于供应资金。FDA面临两个建立其系统的主要挑战:(1)在电子健康记录和账单索赔中使用唯一的设备标识符的使用有限,这使得患者使用的识别设备更加困难; (2)资金注意事项以支持主动监视。FDA已采取行动来鼓励使用唯一的设备标识符,例如与联邦实体协调并发布一份文档,宣传使用对卫生系统的好处。此外,FDA还估计了当前和未来的主动监视成本,并正在考虑如何通过倡导替代资金来源来为工作提供资金的选择。GAO将继续监视FDA在建立主动市场后监视系统方面的进展。GAO将继续监视FDA在建立主动市场后监视系统方面的进展。
欧盟医疗设备调节系统的临床学术观点 - 它应该如何发展?
更有效的脂质降低:LDL目标实践实践支持更密集的LLT方案的需求较少?更可能遵守频率较低?满足患者的期望更好地适应其他动脉粥样硬化脂质:TGRL,LP(a)帮助个性化治疗帮助患者复发事件的复发性疗法?
机器学习医疗设备——人工智能医疗设备的子集:关键术语和定义
人工智能医疗器械子集:关键术语和定义 编写组:IMDRF AIMD 工作组 日期:2021 年 9 月 16 日 本文件由国际医疗器械监管机构论坛制作。本文件的复制或使用不受限制;但是,将本文件的全部或部分纳入其他文件,或将其翻译成英语以外的语言,并不表示或代表国际医疗器械监管机构论坛的任何形式的认可。版权所有 © 2021 国际医疗器械监管机构论坛。
案例研究:马萨诸塞州医疗设备涂料操作的PFAS调查和修复
•自2019年7月以来的PFA非检测 - 排气过滤研究完成 /较高的效率排气过滤器和展位修改也完成(2019年12月) - 完成(2020年3月)(2020年3月) - 水连接(38) /诗人系统的安装(11)安装(11)在私人井中和私人井(7月2020年7月 - 2020年7月 - 2020年7月)在49套住房中完成的(11) - 2020年7月 - 2020年7月 - 2020年7月 - Stonk Work Work,Stonk Work Work -2020年7月(Stonk 3) 2023)•IV阶段补救实施(2023-2024)
调查英国医疗设备再制造技术及其在发展中国家的出口环境
摘要 与发达国家相比,发展中国家明显缺乏医疗设备,因此缩小差距是缩小两国医疗不平等的关键。据了解,由于技术进步速度快,发达国家的医疗系统医疗成像设备(X 射线、MRI、CT 扫描仪等)的周转率很高。因此,发展中国家有大量的二手医疗设备可以通过再制造得到利用。本文旨在研究再制造医疗设备的适用性,以便将上述设备供应给需要的国家。这项调查更清楚地表明了利用再制造为发展中国家提供所需医疗成像设备的可行性。这是通过研究发达国家目前进行的再制造过程(无论是直接通过 OEM 还是第三方进行)并评估所使用的方法如何应用于发展中国家来实现的。研究表明,再制造实践不仅能使发展中国家受益,增加诊断设备的使用,还能创造就业机会,使整个社会受益。再制造过程中应首先关注的一个关键阶段是检查,因为它有助于筛选和选择最适合再制造过程的医疗设备。
远期健康耐用医疗设备(DME)指数和最高费用时间表
如果未在DME索引中列出项目,或者可以使用“未其他分类”(NOC)或其他过程代码,但可能需要事先授权。(请参阅DME索引中特定NOC程序代码的授权要求,请参阅以前的美元金额限制。)随附完整事先授权请求提交的文件必须包括对设备的性质,范围和特定成员特定医疗需求的完整描述。使用品牌和/或模型和价格的制造商产品信息应作为先前授权请求的附件发送。