XiaoMi-AI文件搜索系统
World File Search System帕博利珠单抗单药治疗造成皮肤损伤后,减少...
摘要 ━━ 背景。肉瘤样癌是一种罕见的肺癌类型,一般认为对化疗和放疗具有耐药性。病例。一名 68 岁男性在 2022 年 10 月的一次体检中,在一次简单的胸部 X 光检查中被诊断出异常;随后,他在 2022 年 11 月就诊当地医生,同时出现右侧胸痛。胸部计算机断层扫描 (CT) 显示右下叶结节和胸腔积液,正电子发射断层扫描 (PET) 显示结节和胸膜内有氟脱氧葡萄糖积聚。患者被转诊至我院进行进一步检查和治疗。随后,他于 2022 年 12 月通过 CT 引导活检被诊断为肉瘤样癌。由于程序性细胞死亡配体 1 (PD-L1) 表达水平高,于 2023 年 1 月开始使用派姆单抗;结果,原发肿瘤缩小,胸腔积液减少。随后,出现皮肤反应,2 个周期后停用派姆单抗,但肿瘤大小保持不变。结论。众所周知,在某些非小细胞肺癌病例中,即使在发生免疫相关不良事件后停止治疗后,反应仍会维持。在本例中,在肺肉瘤样癌中观察到了类似的过程。 (JJLC. 2024;64:923-928)关键词 ━━ 肺肉瘤样癌、免疫检查点抑制剂、程序性细胞死亡配体 1 (PD-L1)、帕博利珠单抗
英夫利昔单抗(Avsola®、Inflectra®、Remicade® 和 Renflexis®)
任何未在此处列出的 FDA 批准的英夫利昔单抗生物仿制药产品* *任何未在本政策中列出名称的美国食品药品管理局批准和推出的英夫利昔单抗生物仿制药产品,在 UnitedHealthcare 审核之前,将被视为非首选。用于自行注射皮下注射的英夫利昔单抗 [即 Zymfentra (infliximab-dyyb)] 是根据药房福利获得的。首选产品医疗必需品计划 Inflectra (infliximab-dyyb) 和 Avsola (infliximab-axxq) 是首选的英夫利昔单抗产品。将根据诊断特定标准部分中的承保标准为 Inflectra 或 Avsola 提供承保。 Renflexis (infliximab-abda)、Remicade (infliximab) 或其他非首选英夫利昔单抗产品的保险范围将根据本节中的标准和诊断特定标准部分中的保险范围标准提供。为了继续获得保险,已经使用 Remicade、Renflexis 或其他非首选英夫利昔单抗产品的会员将被要求将治疗改为 Inflectra 或 Avsola,除非他们符合本节中的标准。首选产品标准(有关 Medicare 审核,请参阅 CMS 部分**。)当满足以下两个标准时,使用 Remicade、Renflexis 或其他非首选英夫利昔单抗生物仿制药治疗对于本政策中指定的适应症具有医学必要性:
Tecentriq™ 和 Tecentriq HybrezaTM(阿特珠单抗 IV/SC)
1. 注意:Evolent 政策不支持 Tecentriq(atezolizumab)用于治疗不适合接受顺铂或任何含铂化疗的会员的局部晚期或转移性尿路上皮癌。此政策立场基于 Tecentriq 制造商的自愿退出,其结论是 IMvigor130 验证性研究未达到 Tecentriq 联合化疗与单独化疗相比的总生存期 (OS) 的共同主要终点。请参阅 Evolent 推荐的替代药物/方案,包括但不限于 http://pathways.newcenturyhealth.com 上的方案。
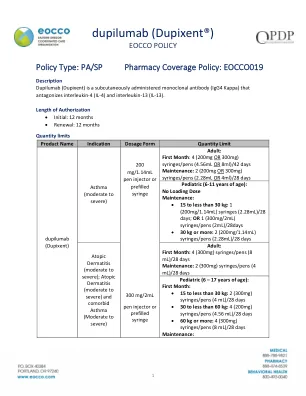
度匹鲁单抗 (Dupixent®)
• 6 岁或以上成员的嗜酸性粒细胞表型的中度至重度哮喘 • 6 岁或以上成员的口服皮质类固醇依赖性哮喘 • 6 个月及以上患者的中度至重度特应性皮炎,其疾病无法通过局部处方疗法得到充分控制 • 12 岁或以上控制不佳的慢性鼻窦炎和鼻息肉 (CRSwNP) 患者的附加维持治疗 • 治疗患有结节性痒疹 (PN) 的成人患者 • 患有中度至重度慢性阻塞性肺病 (COPD) 的成人患者的附加维持治疗,这些患者有发作史和嗜酸性粒细胞表型。II. Dupilumab 试验排除了同时进行生物疗法;此外,缺乏证据支持双重使用生物疗法治疗,并且可能会增加副作用的风险。III. 中度至重度特应性皮炎
使用阿米凡他单抗治疗非小细胞肺癌的皮肤毒性:实用指南和最佳实践
AMIVANTAMAB 是一种双特异性表皮生长因子受体 (EGFR) 和间充质上皮转化因子 (MET) 受体导向抗体,获批与卡铂-培美曲塞联合用于治疗 EGFR 外显子 20 插入变异 (Ex20ins NSCLC) 的非小细胞肺癌患者,作为一线治疗,以及作为铂类化疗后病情进展的 Ex20ins NSCLC 患者的单一疗法。 Amivantamab 还被批准与 EGFR 酪氨酸激酶抑制剂拉泽替尼联合用于一线治疗 EGFR 外显子 19 缺失 (Ex19del) 或外显子 21 L858R 置换患者,以及与卡铂-培美曲塞联合用于 EGFR Ex19del 或 L858R 患者,其在接受奥希替尼治疗后病情进展 (Park 等人,2021 年;强生公司,2024 年;Zhou 等人,2023 年)。美国食品药品监督管理局根据 1 期 CHRYSALIS 试验的结果授予了初步加速批准,该试验发现总体缓解率为 40%(由盲法独立中央审查评估),中位缓解持续时间为 11.1 个月,安全性与 EGFR 和 MET 抑制的预期一致 (Park 等人,2021 年)。 2024 年 3 月,美国食品药品监督管理局全面批准了 amivantamab,并根据 3 期 PAPILLON 试验的结果增加了与化疗联合用于一线治疗的适应症,该试验发现,amivantamab 联合化疗的中位无进展生存期 (11.4 个月) 明显长于单纯化疗 (6.7 个月) (p < 0.001) (Zhou et al., 2023)。2024 年 8 月,美国食品药品监督管理局还根据 3 期 MARIPOSA 试验的结果增加了 EGFR Ex19del 或 L858R 患者与 lazerti nib 联合用于一线治疗的适应症 (Cho et al., 2024)。在 MARIPOSA 中,一线阿米凡他单抗联合拉泽替尼治疗的中位无进展生存期明显长于奥希替尼(23.7 个月对 16.6 个月)(p < 0.001)(Cho 等人,2024 年)。根据 3 期 MARIPOSA-2 试验的结果,在奥希替尼治疗进展后,阿米凡他单抗也于 2024 年底获批与化疗联合治疗 EGFR Ex19del 或 L858R,在该试验中,阿米凡他单抗联合化疗的无进展生存期明显长于单纯化疗(6.3 个月对 4.2 个月)(p < 0.001)(Passaro 等人,2024 年)。
BC PharmaCare 加拉达昔单抗 (Andembry) 药物信息表
加拉达昔单抗通过阻断导致 HAE 发作的一系列事件起作用。具体来说,它抑制血液中缓激肽的过量产生。血液中缓激肽过多会导致遗传性血管性水肿发作,症状包括肿胀和疼痛。发作可能涉及面部、四肢、生殖器、胃肠道或喉咙等部位。如果喉咙部位出现肿胀,遗传性血管性水肿发作可能是致命的。
Enhertu, INN-曲妥珠单抗
此药品需要接受额外监控。这将允许快速识别新的安全信息。请医疗保健专业人员报告任何疑似不良反应。有关如何报告不良反应,请参阅第 4.8 节。 1. 药品名称 Enhertu 100 mg 浓缩粉末,用于输液溶液 2. 定性和定量组成 一瓶浓缩粉末,用于输液溶液,含有 100 mg trastuzumab deruxtecan。配制后,一瓶 5 mL 溶液含有 20 mg/mL trastuzumab deruxtecan(请参阅第 6.6 节)。曲妥珠单抗 deruxtecan 是一种抗体-药物偶联物 (ADC),含有人源化抗 HER2 IgG1 单克隆抗体 (mAb),其氨基酸序列与曲妥珠单抗相同,由哺乳动物 (中国仓鼠卵巢) 细胞产生,通过基于四肽的可裂解接头与 DXd (一种依沙替康衍生物和一种拓扑异构酶 I 抑制剂) 共价连接。每个抗体分子上附着约 8 个 deruxtecan 分子。有关辅料的完整列表,请参阅第 6.1 节。3. 药物形式用于输液溶液的浓缩粉末。白色至黄白色冻干粉末。 4. 临床特点 4.1 治疗适应症 乳腺癌 HER2 阳性乳腺癌 Enhertu 单药疗法适用于治疗已接受过一种或多种抗 HER2 方案的不可切除或转移性 HER2 阳性乳腺癌成年患者。 HER2 低乳腺癌 Enhertu 单药疗法适用于治疗已接受过转移性化疗或在完成辅助化疗期间或后 6 个月内出现疾病复发的不可切除或转移性 HER2 低乳腺癌成年患者(见第 4.2 节)。 非小细胞肺癌 (NSCLC) Enhertu 单药疗法适用于治疗肿瘤具有激活 HER2 (ERBB2) 突变且需要在铂类化疗(联合或不联合免疫疗法)后进行全身治疗的晚期 NSCLC 成年患者。
FOLFOX方案与西妥昔单抗治疗对晚期结肠癌患者疗效和肿瘤标记的原始文章效果
摘要:目的:评估FOLFOX方案与西妥昔单抗在治疗AD vanged结肠癌治疗中的功效。方法:这项回顾性研究涉及60例原发性结肠癌患者,这些患者于2022年1月至2023年2月在PLA海军Anqing医院接受治疗。根据他们的治疗方案,将患者分为一个治疗组,该治疗组与西妥昔单抗合并(n = 30),单独用西妥昔单抗治疗的对照组(n = 30)。比较了两组的一般数据,并通过比较两组之间的完全缓解,部分缓解,稳定疾病(SD)和进行性疾病(PD)的比例来评估短期反应率。此外,比较了两组之间的无进展生存期(PFS)和总生存期(OS),以及不良反应以及血清肿瘤标记(CEA和CA19-9)水平的变化。结果:与对照组相比,观察组显示出明显更高的短期有效率(CR+PR)(56.67%比23.33%)。与对照组相比,观察组的PFS和OS明显更长。在不良反应方面,中性粒细胞减少,血小板减少症,恶心,呕吐和腹泻的发生率相似。但是,观察组皮疹的发生率更高。治疗后,两组的血清CEA和CA19-9水平明显降低,观察组显然表现出低于对照组的水平(P <0.001)。同样,观察组中VEGF-A和VEGFR2水平的降低比对照组中的降低更为重要(所有p <0.001)。结论:尽管诱发了可控的皮疹,但FOLFOX和CETUXIMAB的综合疗法显着提高了短期疗效,降低了CEA,CA19-9,VEGF-A和VEGFR2的水平,并扩大患者的PFS和OS,可以作为患者的PFS和OS,可作为晚期结肠癌的有效治疗策略。
英夫利昔单抗(Remicade®)RMP摘要
风险管理计划(RMP)是一份全面的文件,作为申请档案的一部分,用于市场批准。RMP摘要包含有关药物安全性的信息,并解释了为进一步调查并遵循风险以及预防或最小化这些措施所采取的措施。Remicade®的RMP摘要是一份简洁的文件,并不声称是详尽的。作为一份国际文件,摘要可能与批准并在瑞士出版的“ Arzneimittelinformation / Information SurLeMédicament”不同,例如提及在瑞士授权中未包括的人口中发生的风险或指示。请注意,在瑞士有效且安全地使用Remicade®的参考文档是“ Arzneimittelinformation / Information Sur sur leMédicament”(请参阅www.swissmedic.ch)批准和授权,并由瑞士中间体批准。Janssen-Cilag Ag完全负责Remicade®已发表的RMP摘要rmp的含量的准确性和正确性。
推荐报告 帕妥珠单抗和曲妥珠单抗...
2024 卫生部。允许部分或全部复制本作品,但必须注明来源,且不得用于销售或任何商业目的。 Conitec 负责本作品中的文本和图像的版权。编制、分发和信息 卫生部 科学、技术和创新及卫生经济工业综合体秘书处 - SECTICS 卫生技术管理和整合部 - DGITS 卫生技术评估总体协调 - CGATS Esplanada dos Ministérios,Bloco G,Edifício Sede,8 楼 CEP:70.058-900 - Brasília/DF 电话:(61) 3315-2848 网站:https://www.gov.br/conitec/pt-br 电子邮件:conitec@saude.gov.br 报告编制 巴拉那联邦大学卫生技术评估中心 - NATS-UFPR Astrid Wiens Souza Lina Tieco Doi Mariana Millan Fachi 技术前景监测 监测协调健康技术 - CMTS/DGITS/SECTICS/MS 患者视角 技术整合协调 - CITEC/DGITS/SECTICS/MS Adriana Prates Aérica de Figueiredo Pereira Meneses Andrea Brígida de Souza Luiza Nogueira Losco Melina Sampaio de Ramos Barros 评审 Daniel da Silva Pereira Curado - CGATS/DGITS/SECTICS/MS Fernanda D'athayde Rodrigues - CGATS/DGITS/SECTICS/MS Luciana Costa Xavier - CGATS/DGITS/SECTICS/MS 协调 Priscila Gebrim Louly - CGATS/DGITS/SECTICS/MS Luciana Costa Xavier - CGATS/DGITS/SECTICS/MS 监督 Luciene Fontes Schluckebier Bonan - DGITS/SECTICS/MS