XiaoMi-AI文件搜索系统
World File Search System卵巢癌的战略组合疗法
3病理学系,李卡·谢兴医学院,香港大学,香港,通讯作者:Lydia Wt Cheung。L1-44,香港Sassoon Road 21实验室街区。 电话:852-39176908传真:852-28170857;电子邮件:lydiacwt@hku.hk摘要卵巢癌仍然是全球女性与妇科癌症有关的主要原因。 沮丧的存活率部分是由于标准化的脱毛手术和一线化学疗法后复发。 近年来,有针对性的疗法在内,包括抗血管生成剂或聚(ADP-核糖)聚合酶抑制剂代表了卵巢癌治疗中的突破。 随着更多的治疗剂通过对卵巢癌生物学的更深入了解,正在积极研究一系列组合治疗方法,以进一步改善该疾病的临床结果。 这些组合涉及DNA损害剂,靶向信号通路和免疫疗法的靶向疗法,同时靶向多个癌症途径或标志以诱导添加剂或协同的抗肿瘤活动。 在这里,我们回顾了临床前数据和正在进行的临床试验,以开发有效的组合疗法治疗卵巢癌。 这些新出现的治疗方式可能会重塑该疾病的治疗局势。L1-44,香港Sassoon Road 21实验室街区。电话:852-39176908传真:852-28170857;电子邮件:lydiacwt@hku.hk摘要卵巢癌仍然是全球女性与妇科癌症有关的主要原因。沮丧的存活率部分是由于标准化的脱毛手术和一线化学疗法后复发。近年来,有针对性的疗法在内,包括抗血管生成剂或聚(ADP-核糖)聚合酶抑制剂代表了卵巢癌治疗中的突破。随着更多的治疗剂通过对卵巢癌生物学的更深入了解,正在积极研究一系列组合治疗方法,以进一步改善该疾病的临床结果。这些组合涉及DNA损害剂,靶向信号通路和免疫疗法的靶向疗法,同时靶向多个癌症途径或标志以诱导添加剂或协同的抗肿瘤活动。在这里,我们回顾了临床前数据和正在进行的临床试验,以开发有效的组合疗法治疗卵巢癌。这些新出现的治疗方式可能会重塑该疾病的治疗局势。缩写:ACT,收养细胞转移; ATR,共济失调性远程和RAD3相关蛋白; CAR-T,嵌合抗原受体T; CHK1,检查点激酶1; Cho,中国仓鼠卵巢; CI,置信区间; CTLA-4,细胞毒性T-淋巴细胞抗原4; CXCR4,C-X-C趋化因子受体4型; DCR,疾病控制率; DOR,响应持续时间; EGFR,表皮生长因子受体; FA,Fanconi贫血; HDR,同源性DNA修复;人力资源,危险比; ICL,链间交叉链接; IL-2,白介素2; INF-γ,干扰素 - γ; MAPK,有丝分裂原激活的蛋白激酶; MDSC,髓样衍生的抑制细胞; MEK,有丝分裂原激活的蛋白激酶激酶; ORR,客观响应率; OS,整体生存; PARP,聚(ADP-核糖)聚合酶; PD-1,编程细胞死亡-1; PD-L1,编程死亡配体1; PDGFR,血小板衍生的生长因子受体; PDX,患者衍生的异种移植物; PFS,无进展的生存; PI3K,磷酸肌醇3-激酶; PLD,叶珠脂体阿霉素; PR,部分反应; RTK,受体酪氨酸激酶; SD,稳定疾病; TAA,肿瘤相关抗原(TAA); TIL,肿瘤浸润淋巴细胞; TME,肿瘤微环境; Treg,调节性T细胞; VEGF,血管内皮生长因子; VEGFR,血管内皮生长因子受体
类器官和上皮卵巢癌 - ...
摘要。上皮卵巢癌(EOC)是全世界女性癌症相关死亡的第五个主要原因。尽管有80%的病例对初始治疗做出了很好的反应,但> 70%的病例在头两年内发展出复发性疾病并变得化学抗性。因此,预测性生物标志物非常需要指导治疗。在精确医学的时代,细节型被研究为预测治疗对肿瘤治疗的治疗反应的功能方法。本系统审查的总体目的是揭示患者衍生的类器官的当前状态及其对EOC进行药物筛查的能力。使用PubMed和Cochrane文库进行了研究研究卵巢癌和类器官的研究。总共10项研究符合纳入标准。在六项研究中描述了器官的生长速率,并在29%至90%之间变化。只有四项研究包括有关临床结果的数据,并表明临床反应和药物筛查结果之间存在正相关。间和肿瘤内和肿瘤内杂种。他们都建议类器官重新接收肿瘤异质性。只有一项研究对从不同肿瘤部位获得的类器官进行了药物筛查,并从同一患者患有EOC的患者进行转移,并揭示了所有患者至少对一种药物的反应不同。总而言之,类器官可以提供一种平台 - 预测对化学疗法和基因靶向疗法的临床反应。但是,结果仅是探索方法,并且已发表的药物筛查研究的数量很少。需要进一步的研究来证明类器官能够支持EOC患者的肿瘤学治疗选择。
卵巢癌的炎症和免疫力-NWUS
由于缺乏症状和/或特定的诊断生物标志物,在晚期诊断出超过75%的EOC患者[2]。eoc主要在腹膜腔内传播,并且仅是侵入性的。在进行表演后,有80%的患者经历了有限的治疗选择和生存率差的患者。EOC可以视为免疫原性肿瘤,因为在约55%的患者中可以检测到自发的抗肿瘤免疫反应[3]。有趣的是,乳腺癌和卵巢癌易感性蛋白(BRCA)1/2(BRCA降低的肿瘤)的患者表现出较高的突变负荷和独特的炎性症状特征,肿瘤 - 纤维纤维纤维纤维组成型淋巴细胞(TILS)以及LIG的表达(PD)(PD)(PD)(PD)(PD)(pD)(pD)(pD)(pD)(pD)(pD)(pD)(pD)(pD)。同源重新组(HR)E促肿瘤[4,5]。此外,富含T细胞的肿瘤患者的无进展和总生存期更长[6],而免疫逃避的机械性与生存率差有关[7,8]。所有这些证据共同表明,EOC患者可能会受到免疫疗法的好处。然而,抑制细胞毒性T淋巴细胞E相关蛋白4(CTLA-4)或PD-1或PD-L1轴抑制细胞毒性T淋巴细胞E仅产生适度的EOC [9,10]的抗体[9,10]。缺乏免疫疗法在卵巢癌中的成功可以归因于转化细胞与托有这种质疑的独特肿瘤微环境(TME)的动态相互作用。因此,了解该肿瘤TME中存在的复杂免疫抑制网络对于发展更有效的免疫治疗的发展至关重要。
精密医学时代的卵巢癌
1L,第四行; Brca m。 GOG,妇科肿瘤学; PT,铂。1。汉堡RA和Al。 n Engel J Med 2011; 365:2473-2483。 2。 Perren TJ等。 n Engel J Med 2011; 365:2484-2496。 3。 n Engel J Med 2018; 379(26):2495-2 4。 福音 - 马丁A和Al。 n Engel J Med 2019; 381(25):2391-2402。 5。 Ray-Coquar I和Al。 n Engel J Med 2019; 381(25):2416-2428。 6。 Coleman RL和Al。 n Engel J Med 2019; 381(25):2403-2415。 7。 欧洲机构医学。 出版于2011年9月22日。 访问2021年6月7日。 8。 F. Roche Ltd. 公共新闻13,2018年。 访问2021年6月7日。 9。 我们。 出版的欺骗者26,2018年。 访问2021年6月7日。 10。 欧洲机构医学。 出版于2019年4月26日。 访问2021年6月7日。 11。 glaxosmithkline。 出版于2020年4月29日。 访问2021年6月7日。 12。 glaxosmithkline。 2020年10月29日。 访问2021年6月7日。 13。 我们。 2020年5月11日。 访问2021年6月7日。 14。 欧洲机构医学。 出版于2020年9月17日。汉堡RA和Al。n Engel J Med2011; 365:2473-2483。2。Perren TJ等。n Engel J Med2011; 365:2484-2496。3。n Engel J Med2018; 379(26):2495-2 4。 福音 - 马丁A和Al。 n Engel J Med 2019; 381(25):2391-2402。 5。 Ray-Coquar I和Al。 n Engel J Med 2019; 381(25):2416-2428。 6。 Coleman RL和Al。 n Engel J Med 2019; 381(25):2403-2415。 7。 欧洲机构医学。 出版于2011年9月22日。 访问2021年6月7日。 8。 F. Roche Ltd. 公共新闻13,2018年。 访问2021年6月7日。 9。 我们。 出版的欺骗者26,2018年。 访问2021年6月7日。 10。 欧洲机构医学。 出版于2019年4月26日。 访问2021年6月7日。 11。 glaxosmithkline。 出版于2020年4月29日。 访问2021年6月7日。 12。 glaxosmithkline。 2020年10月29日。 访问2021年6月7日。 13。 我们。 2020年5月11日。 访问2021年6月7日。 14。 欧洲机构医学。 出版于2020年9月17日。2018; 379(26):2495-24。福音 - 马丁A和Al。n Engel J Med2019; 381(25):2391-2402。 5。 Ray-Coquar I和Al。 n Engel J Med 2019; 381(25):2416-2428。 6。 Coleman RL和Al。 n Engel J Med 2019; 381(25):2403-2415。 7。 欧洲机构医学。 出版于2011年9月22日。 访问2021年6月7日。 8。 F. Roche Ltd. 公共新闻13,2018年。 访问2021年6月7日。 9。 我们。 出版的欺骗者26,2018年。 访问2021年6月7日。 10。 欧洲机构医学。 出版于2019年4月26日。 访问2021年6月7日。 11。 glaxosmithkline。 出版于2020年4月29日。 访问2021年6月7日。 12。 glaxosmithkline。 2020年10月29日。 访问2021年6月7日。 13。 我们。 2020年5月11日。 访问2021年6月7日。 14。 欧洲机构医学。 出版于2020年9月17日。2019; 381(25):2391-2402。5。Ray-Coquar I和Al。n Engel J Med2019; 381(25):2416-2428。 6。 Coleman RL和Al。 n Engel J Med 2019; 381(25):2403-2415。 7。 欧洲机构医学。 出版于2011年9月22日。 访问2021年6月7日。 8。 F. Roche Ltd. 公共新闻13,2018年。 访问2021年6月7日。 9。 我们。 出版的欺骗者26,2018年。 访问2021年6月7日。 10。 欧洲机构医学。 出版于2019年4月26日。 访问2021年6月7日。 11。 glaxosmithkline。 出版于2020年4月29日。 访问2021年6月7日。 12。 glaxosmithkline。 2020年10月29日。 访问2021年6月7日。 13。 我们。 2020年5月11日。 访问2021年6月7日。 14。 欧洲机构医学。 出版于2020年9月17日。2019; 381(25):2416-2428。6。Coleman RL和Al。n Engel J Med2019; 381(25):2403-2415。 7。 欧洲机构医学。 出版于2011年9月22日。 访问2021年6月7日。 8。 F. Roche Ltd. 公共新闻13,2018年。 访问2021年6月7日。 9。 我们。 出版的欺骗者26,2018年。 访问2021年6月7日。 10。 欧洲机构医学。 出版于2019年4月26日。 访问2021年6月7日。 11。 glaxosmithkline。 出版于2020年4月29日。 访问2021年6月7日。 12。 glaxosmithkline。 2020年10月29日。 访问2021年6月7日。 13。 我们。 2020年5月11日。 访问2021年6月7日。 14。 欧洲机构医学。 出版于2020年9月17日。2019; 381(25):2403-2415。7。欧洲机构医学。出版于2011年9月22日。访问2021年6月7日。8。F. Roche Ltd.公共新闻13,2018年。访问2021年6月7日。9。我们。出版的欺骗者26,2018年。访问2021年6月7日。10。欧洲机构医学。出版于2019年4月26日。访问2021年6月7日。11。glaxosmithkline。出版于2020年4月29日。访问2021年6月7日。12。glaxosmithkline。2020年10月29日。访问2021年6月7日。13。我们。2020年5月11日。访问2021年6月7日。14。欧洲机构医学。出版于2020年9月17日。访问June 7,2021。
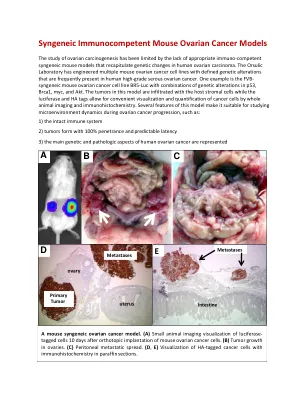
同基因小鼠卵巢癌细胞系-...
同基因免疫功能小鼠卵巢癌模型 由于缺乏合适的免疫功能同基因小鼠模型来重现人类卵巢癌的基因变化,卵巢癌的研究受到了限制。Orsulic 实验室已设计出多种小鼠卵巢癌细胞系,这些细胞系具有明确的基因改变,这些改变经常出现在人类高级别浆液性卵巢癌中。一个例子是 FVB 同基因小鼠卵巢癌细胞系 BR5-Luc,其具有 p53、Brca1、myc 和 Akt 基因改变的组合。该模型中的肿瘤浸润有宿主基质细胞,而荧光素酶和 HA 标签可通过整体动物成像和免疫组织化学方便地可视化和量化癌细胞。该模型的几个特点使其适合研究卵巢癌进展过程中的微环境动态,例如:
子宫和卵巢癌的靶向剂
Crosbie EJ等。子宫内膜癌。柳叶刀。2022; 399(10333):1412-28。Morice P等。子宫内膜癌。柳叶刀。2016; 387(10023):1094-108。 Kurnit KC等。 在子宫癌女性中合并症的患病率增加。 Gynecol Oncol。 2015; 138(3):731-4。 Onstad Ma等。 解决肥胖在子宫内膜癌风险,预防和治疗中的作用。 J Clin Oncol。 2016; 34(35):4225-30。 Guo Jz等。 对子宫内膜癌的孟德尔随机研究的回顾。 前内分泌(Lausanne)。 2022; 13:783150。 Liu L等。 按年龄,种族和种族划分的子宫内膜癌发病率上升的差异趋势。 JNCI癌症谱。 2023; 7(1):PKAD001。 concin n等。 ESGO/ESTRO/ESP用于管理子宫内膜癌患者的指南。 int j gynecol癌。 2021; 31(1):12-39。2016; 387(10023):1094-108。Kurnit KC等。 在子宫癌女性中合并症的患病率增加。 Gynecol Oncol。 2015; 138(3):731-4。 Onstad Ma等。 解决肥胖在子宫内膜癌风险,预防和治疗中的作用。 J Clin Oncol。 2016; 34(35):4225-30。 Guo Jz等。 对子宫内膜癌的孟德尔随机研究的回顾。 前内分泌(Lausanne)。 2022; 13:783150。 Liu L等。 按年龄,种族和种族划分的子宫内膜癌发病率上升的差异趋势。 JNCI癌症谱。 2023; 7(1):PKAD001。 concin n等。 ESGO/ESTRO/ESP用于管理子宫内膜癌患者的指南。 int j gynecol癌。 2021; 31(1):12-39。Kurnit KC等。在子宫癌女性中合并症的患病率增加。Gynecol Oncol。2015; 138(3):731-4。 Onstad Ma等。 解决肥胖在子宫内膜癌风险,预防和治疗中的作用。 J Clin Oncol。 2016; 34(35):4225-30。 Guo Jz等。 对子宫内膜癌的孟德尔随机研究的回顾。 前内分泌(Lausanne)。 2022; 13:783150。 Liu L等。 按年龄,种族和种族划分的子宫内膜癌发病率上升的差异趋势。 JNCI癌症谱。 2023; 7(1):PKAD001。 concin n等。 ESGO/ESTRO/ESP用于管理子宫内膜癌患者的指南。 int j gynecol癌。 2021; 31(1):12-39。2015; 138(3):731-4。Onstad Ma等。 解决肥胖在子宫内膜癌风险,预防和治疗中的作用。 J Clin Oncol。 2016; 34(35):4225-30。 Guo Jz等。 对子宫内膜癌的孟德尔随机研究的回顾。 前内分泌(Lausanne)。 2022; 13:783150。 Liu L等。 按年龄,种族和种族划分的子宫内膜癌发病率上升的差异趋势。 JNCI癌症谱。 2023; 7(1):PKAD001。 concin n等。 ESGO/ESTRO/ESP用于管理子宫内膜癌患者的指南。 int j gynecol癌。 2021; 31(1):12-39。Onstad Ma等。解决肥胖在子宫内膜癌风险,预防和治疗中的作用。J Clin Oncol。2016; 34(35):4225-30。 Guo Jz等。 对子宫内膜癌的孟德尔随机研究的回顾。 前内分泌(Lausanne)。 2022; 13:783150。 Liu L等。 按年龄,种族和种族划分的子宫内膜癌发病率上升的差异趋势。 JNCI癌症谱。 2023; 7(1):PKAD001。 concin n等。 ESGO/ESTRO/ESP用于管理子宫内膜癌患者的指南。 int j gynecol癌。 2021; 31(1):12-39。2016; 34(35):4225-30。Guo Jz等。 对子宫内膜癌的孟德尔随机研究的回顾。 前内分泌(Lausanne)。 2022; 13:783150。 Liu L等。 按年龄,种族和种族划分的子宫内膜癌发病率上升的差异趋势。 JNCI癌症谱。 2023; 7(1):PKAD001。 concin n等。 ESGO/ESTRO/ESP用于管理子宫内膜癌患者的指南。 int j gynecol癌。 2021; 31(1):12-39。Guo Jz等。对子宫内膜癌的孟德尔随机研究的回顾。前内分泌(Lausanne)。2022; 13:783150。Liu L等。 按年龄,种族和种族划分的子宫内膜癌发病率上升的差异趋势。 JNCI癌症谱。 2023; 7(1):PKAD001。 concin n等。 ESGO/ESTRO/ESP用于管理子宫内膜癌患者的指南。 int j gynecol癌。 2021; 31(1):12-39。Liu L等。按年龄,种族和种族划分的子宫内膜癌发病率上升的差异趋势。JNCI癌症谱。2023; 7(1):PKAD001。concin n等。ESGO/ESTRO/ESP用于管理子宫内膜癌患者的指南。int j gynecol癌。2021; 31(1):12-39。
治疗晚期卵巢癌的新策略
晚期卵巢癌(AOC)容易复发,这可以归因于耐药性。耐药性可能与肿瘤微环境(TME)有关,包括免疫和非免疫TME。在免疫TME中,免疫效应细胞(例如树突状细胞(DC),M1样肿瘤相关巨噬细胞(M1-TAM)和T细胞被抑制。相反,激活了免疫抑制性细胞,例如M2样肿瘤相关的巨噬细胞(M2- TAM),髓样衍生的抑制细胞(MDSC)和调节性T细胞(Tregs)。这些变化使得产生免疫作用并影响化学免疫疗法的效率很难。在非免疫TME中,诸如凋亡抑制,DNA损伤反应(DDR)和上皮 - 间质转变(EMT)等机制可以促进肿瘤的生长,转移和耐药性。尽管TME在AOC治疗中提出了挑战,但纳米颗粒(NP)的独特生物学优势使调节TME成为可能。nps可以刺激M1-TAM,DC和T细胞的免疫反应,同时减少免疫抑制细胞(例如M2-TAMS和Tregs)的内化,从而调节AOC免疫TME。此外,NP可以通过减少AOC细胞的凋亡,抑制同源重组(HR)修复,反转EMT并实现逆转耐药性的效果来调节非免疫TME。总而言之,NPS的应用为AOC提供了一些新的临床治疗场所。
卵巢癌的致癌途径和靶向治疗
摘要:上皮性卵巢癌 (EOC) 是最具侵袭性的妇科恶性肿瘤之一。被诊断患有 OC 的女性的存活率仍然很低,因为大多数患者被诊断时已处于晚期疾病。减瘤手术和铂类疗法是目前 OC 治疗的主要手段。然而,尽管最初获得了缓解,但很大一部分患者会因为先天和后天的耐药性而复发,此时该疾病被认为是无法治愈的。鉴于此,需要新的检测策略和治疗方法来改善 OC 患者的预后和存活率。在这篇综述中,我们总结了我们目前对 OC 及其许多亚型的遗传图谱和分子通路的了解。通过研究在临床前和临床环境中探索的治疗策略,我们强调了解码单一和趋同基因改变如何共存并驱动 OC 进展和对当前治疗的耐药性的重要性。我们还提出,PI3K 和 MAPK 通路等核心信号通路在不同 OC 亚型的起源中发挥着关键作用,并且可以与已知的 DNA 损伤修复通路结合成为开发定制化、更有效的抗癌治疗方法的新靶点。