XiaoMi-AI文件搜索系统
World File Search System现代奴隶制法案 - Evotec(UK)Limited
•原发性HU和啮齿动物肝细胞和细胞系; IPSC衍生的肝细胞和器官•原发性和不朽的Hu肝星状细胞•原代HU PBMC衍生的免疫细胞含有。巨噬细胞,单核细胞; Hu Kupffer细胞,小鼠BMDM;细胞系•3D HU原发性肝球体,小鼠精度切割肝切片•代谢,炎症,纤维化测定
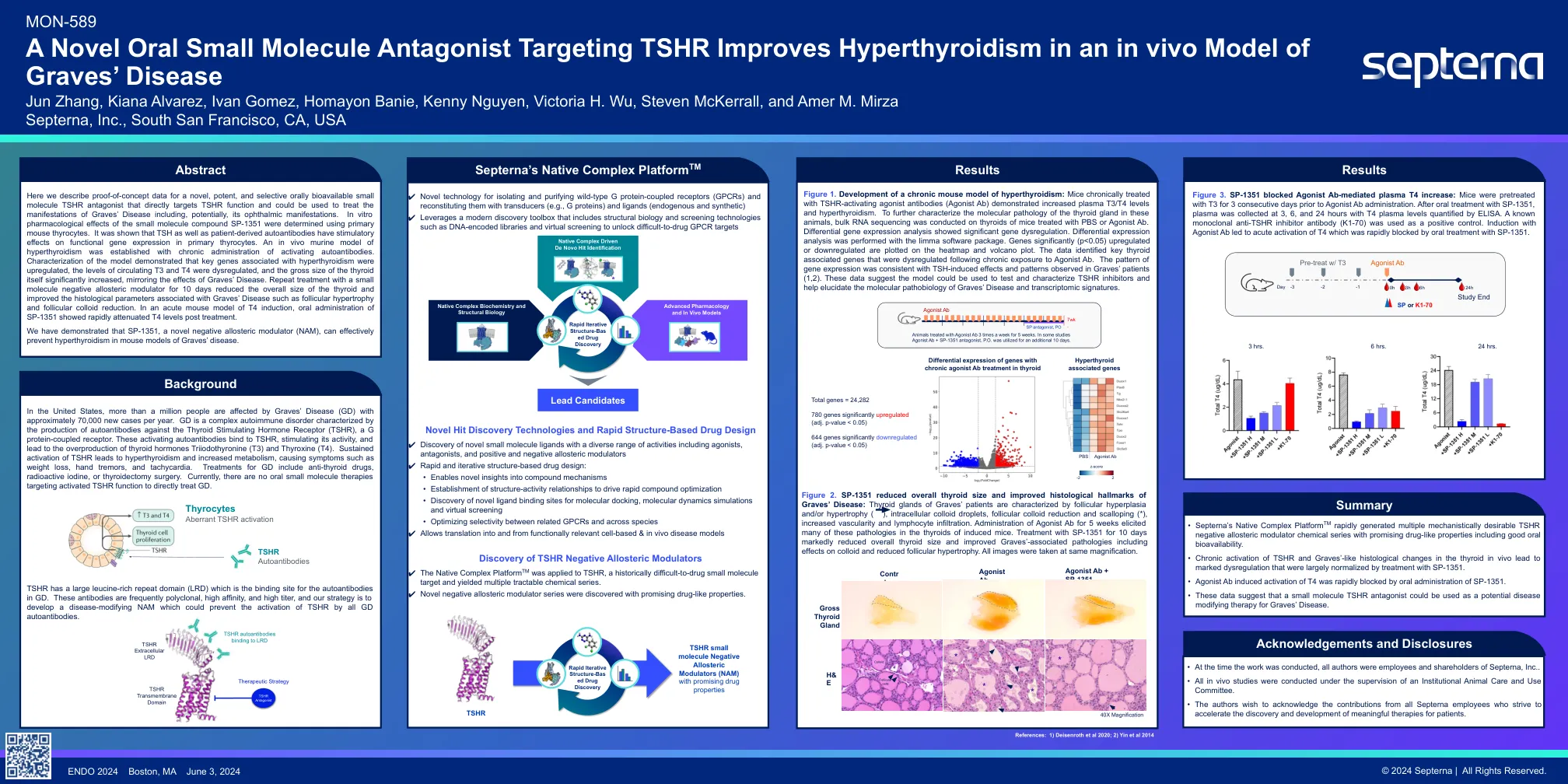
靶向TSHR的一种新型的口服小分子拮抗剂可改善Graves疾病的体内模型Jun Zhang,Kiana Alvarez,Ivan G
在这里,我们描述了一种新型,有效和选择性的口服生物可利用的小分子TSHR拮抗剂的概念证明数据,该分子TSHR拮抗剂直接靶向TSHR功能,可用于治疗坟墓疾病的表现,包括潜在的眼科表现。使用原代小鼠甲状腺细胞确定小分子化合物SP-1351的体外药理作用。表明,TSH和患者衍生的自身抗体对原代胆红素的功能基因表达产生刺激作用。通过长期激活自身抗体的施用,建立了甲状腺功能亢进症的体内鼠模型。该模型的表征表明,与甲状腺功能亢进相关的关键基因被上调,循环T3和T4的水平失调,甲状腺本身的总体大小显着增加,反映了坟墓疾病的影响。用小分子负构构调节剂重复治疗10天,降低了甲状腺的总体大小,并改善了与Graves疾病(如卵泡肥大和卵泡胶体还原)相关的组织学参数。在T4诱导的急性小鼠模型中,口服SP-1351的口服给予治疗后的T4水平迅速减弱。
使用CRISPRA和CRISPRI
使用核酸酶折叠的cas9融合到转录效应子分子的核酸酶,可以用CRISPR-CAS9系统(CRISPRA/CRISPRI)诱导靶向转录激活或干扰。这些技术已在癌细胞系中使用,特别是用于使用慢病毒载体的全基因组功能遗传筛选。但是,由于缺乏有效和无毒的递送方式,CRISPRA和CRISPRI尚未广泛应用于具有治疗相关性的离体培养的原代细胞。在这里,我们通过电穿孔基于RNA或核糖核蛋白(RNP)递送的CRISPRA和CRISPRI平台,并在原代细胞(包括人CD34 +血液 - 诗歌干和祖细胞和祖细胞(HSPC)和人CD3 + T细胞中显示短暂的,可编程的基因调节。我们使用来自不同细菌物种的多个SGRNA和CRISPR系统显示了多重和正交基因调制,并且我们表明CRISPRA可用于操纵HSPC的分化轨迹。这些平台构成了简单有效的手段,可以瞬时控制转录,并通过合成SGRNA轻松地采用并将其重新编程为新的靶基因。我们认为,这些技术将在工程中广泛使用用于干细胞生物学和基因功能的转录组,并且我们预计它们将被实施以开发和增强细胞疗法。
计划参展商 - 细胞和实验生物学
生物块是可自定义的3D多孔水凝胶底物,可实时观察,新颖的刺激引入,共培养和细胞分析。该结构促进了大规模的产生,而无需更改底物并将患者(和源)细胞保持在本地状态。利用其专有方法,他们引入了一种开创性的方法,以在3D环境中培养原代组织,干细胞和生产细胞系,而
基因组编辑技术基础知识产权...
使您能够编辑基因组中的任何位置图 1. 使用 TALXcell 平台敲除 T 细胞受体 (TCR)。使用 Invitrogen ™ Neon ™ 转染系统通过电穿孔将 TALXcell mRNA 递送至原代人类 T 细胞。使用藻红蛋白 (PE) 偶联的 TCR 抗体通过流式细胞术测量 TCR 敲除效率。TALXcell 平台实现了 94.9% 的 TCR 敲除效率,这与在类似实验中使用 CRISPR-Cas9 观察到的效率相似。
Cryo-SFM Plus
我们的Cryo-SFM Plus是定义的,无动物的不含动物,无蛋白质的冷冻剂培养基。优化的公式基于甲基纤维素,DMSO和其他冷冻保护剂。Cryo-SFM Plus和Cryo-SFM Plus,无苯酚无红培养基提供了所有类型的细胞,包括原代人类细胞,干细胞和细胞系。细胞在冷冻-SFM Plus或Cryo-SFM Plus中冷冻,苯酚无红的优势生存能力,附着和随后的融化后生长性能。
高亲和力 CD16 整合到 CRISPR/Cas9 编辑的 CD38 基因座中可增强原代人类自然杀伤细胞的 CD38 定向抗肿瘤活性
摘要 背景 过继转移具有增强的抗体依赖性细胞毒作用 (ADCC) 能力和对 CD38 靶向性抗性的自然杀伤 (NK) 细胞有可能增强达雷木单抗 (DARA) 的临床抗骨髓瘤活性。因此,我们试图开发一种有效的基于 CRISPR/Cas9 的基因编辑平台,以破坏离体扩增的 NK 细胞中的 CD38 表达 (CD38 敲除 (KO)),并同时为 CD38 KO NK 细胞配备高亲和力 CD16 (CD16-158V) 受体。方法 使用 Cas9 核糖核蛋白复合物生成 CD38 KO 人 NK 细胞。通过结合信使 RNA (mRNA) 转染 CD38 KO NK 细胞和在 CD38 位点插入靶向基因以介导基因敲入 (KI),扩展了该平台。在体外和 MM.1S 异种移植小鼠模型中测试了这些基因编辑的 NK 细胞在 DARA 存在下持续存在和介导 ADCC 的能力。结果在体外扩增的 NK 细胞中实现了高效的 CD38 基因破坏,而不会影响其增殖或功能能力。CD38 KO 赋予了对 DARA 诱导的 NK 细胞自相残杀的抗性,在体外和 MM.1S 异种移植小鼠模型中,在 DARA 存在下,能够持续存在并增强对骨髓瘤细胞系的 ADCC。CD38 KO NK 细胞可以通过转染编码 CD16-158V 受体的 mRNA 进一步修饰,从而增强 DARA 介导的 ADCC。最后,我们观察到针对 CD38 基因座的同源定向修复模板促进了有效的 2 合 1 CD38 KO 与截短 CD34 报告基因和 CD16-158V 受体的 KI 结合,CD38 KO /CD16 KI NK 细胞在体外和体内均表现出 DARA 介导的 ADCC 的进一步增强。结论使用体外扩增的 CD38 KO /CD16 KI NK 细胞进行过继免疫治疗有可能提高 DARA 的临床疗效。通过将互补的基因工程策略整合到 CD38 KO 制造平台中,我们生成了具有显著增强的 CD38 定向抗肿瘤活性的 NK 细胞,为在临床上探索这种免疫治疗策略奠定了坚实的基础。
直接移植天真的鼠Cas9+ T细胞的快速有效基因编辑
原代T细胞的基因编辑是一项困难的任务。但是,对于研究,尤其对于临床T细胞转移非常重要。crispr/cas9是最强大的基因编辑技术。必须通过逆转录病毒转导或核糖核蛋白复合物的电穿孔来应用于细胞。只有静息T细胞才有可能后者。在这里,我们使用Cas9转基因小鼠,并证明仅使用GuiderNA的幼稚CD3 + T细胞的预刺激,重要的是。这被证明是迅速而有效的,无需进一步选择。同时靶向。il-7在体外支持了生存和天真,但T细胞在核反射后也可以立即移植,并像未经处理的T细胞一样引起其功能。因此,代谢重编程在几天内达到了正常水平。在GVHD的主要不匹配模型中,不仅是NFATC1和/或NFATC2的消融,而且在幼稚的原代鼠Cas9 + CD3 + T细胞中,NFAT-target基因IRF4也通过GRNA唯一的核反理放大GVHD。然而,在单个NFATC1或NFATC2敲除时,预激活的鼠T细胞无法长期保护GVHD。这强调了同种异性造血干细胞移植期间基因编辑和转移未刺激的人T细胞的必要性。
标题:近乎完美的人类造血干细胞和祖细胞的精确靶向编辑
3 加拿大蒙特利尔大学细胞病理学和生物学系 摘要:对原代造血干细胞和祖细胞 (HSPC) 进行精确基因编辑将有助于单基因疾病的治愈性治疗以及疾病建模。然而,即使使用 CRISPR/Cas 系统,精确效率仍然有限。通过优化向导 RNA 递送、供体设计和添加剂,我们现在已经在原代脐带血 HSCP 上获得了 >90% 的平均精确编辑效率,同时毒性极小且未观察到脱靶编辑。实现如此高效率所需的主要协议修改是添加 DNA-PK 抑制剂 AZD7648,以及在供体中加入破坏间隔区的静默突变以及破坏 PAM 序列的突变。至关重要的是,编辑甚至跨越了祖细胞层级,没有显著扭曲层级或影响集落形成细胞测定中的谱系输出或高自我更新潜力长期培养起始细胞的频率。由于许多疾病的建模需要杂合性,我们还证明了可以通过添加突变体和野生型供体的特定混合物来调整整体编辑和杂合性。通过这些优化,现在可以在人类 HSPC 中直接以近乎完美的效率完成编辑。这将为治疗策略和疾病建模开辟新的途径。