XiaoMi-AI文件搜索系统
World File Search System原发性代谢调整的自然变化决定了模型中的铵耐性。
酶活性通过用500μl的提取缓冲液进行vig口摇(20%(v/v)甘油,1%triton X-100(v/v),50 mm hepes – koH(ph 7.5),10 mm mgcl 2,1 mm edta,1%triton x-100(v/v),1%Triton X-100(V/V),1%Triton X-100(V/V),1%Triton X-100(V/V),1%Triton X-100(V/V),1%Triton X-100(V/V),1%Triton X-100(V/V),1%Triton X-100(v/v),1%X-100(v/v),1%MM emMM MM E.酸,1 mm苯甲米丁,20μM亮肽素,0.5 mM DTT,1 mM苯基甲基磺酰基氟化物,10%聚乙烯基 - 丙吡咯烷酮(W/V)]。葡萄糖激酶(GK),FRUC TOKINAPE(FK),谷氨酸脱氢酶(GDH),磷酸烯醇丙酮酸羧化酶(PEPC),苹果酸脱氢酶(MDH),丙酮酸激酶(PK),总浓酸酯(CM),米尔酸酯(CS),米尔酸酯(CM),米尔酸酯(CM)通过分光光度法测定NADP依赖性的异戊酸脱氢酶(ICDH)酶,并用机器化的微孔板测定法测定(Gibon等人。,2004)。在25°C孵育后,NAD(P)H的演变在340 nm处被固定在340 nm处。通过循环反应在570 nm处测量了GDH的活性,涉及在存在醇脱氢酶和苯嗪硫代硫酸盐的情况下,涉及3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑四唑。cs ac ac titive。(2003)。通过检查生物标准(番茄叶提取物)的恢复,并确保提取物的稀释对活动的估计没有影响,如Bénard和Gibon(2016)所述,可以通过检查生物标准的恢复(番茄叶提取物)来验证。
什么是原发性进行性失语症?
这些因素共同帮助医生找出导致言语障碍和其他症状的原因。PPA 是一种罕见的痴呆症,医生通常不会看到。这意味着可能需要比平时更长的时间才能得到正确的诊断。确诊后,许多人会想为未来做计划。这包括关于工作、生活方式和驾驶、护理选择、法律和金钱问题的决定。请在第 18 页了解有关痴呆症家庭的帮助和支持的信息。
新型IL2RG基因突变引起了原发性免疫疾病:病例报告和文献综述
这项研究提出了一个详细的临床病例,该病例是一个10岁男孩,病史长期咳嗽,发烧和支气管扩张的诊断延迟。对此案的审查表明,该儿童从小就患有支气管炎,中耳炎,皮肤过敏和病毒疣,表明免疫系统持续性异常。成像研究,包括肺和窦CT扫描,显示出明显的支气管扩张,并伴有感染和鼻窦炎。免疫评估显示免疫球蛋白水平和T细胞分布中的异常情况,表明潜在的免疫缺陷。整个外科体测序未鉴定与支气管扩张的高度相关并确定性致病性的任何遗传变异,但检测到IL2RG基因中的IL2RG中的复合杂合杂合的错义突变C.420a> t(P.R140S),该基因与主要的免疫缺陷(CID)相关(CID),这是一个临床型物型,cliNOTE;本案例报告不仅增强了我们对CID的理解,而且还为CID的遗传景观提供了新的添加,在国内和国际上,有助于早期诊断和治疗临床实践中此类疾病。在18个月的随访期间,孩子无法参加体育活动,并且经历了复发性的鼻炎,鼻窦炎和疣。孩子的当前体重和身高分别为30公斤和140厘米。
原发性中枢神经系统淋巴瘤患者接受 CD19 靶向嵌合抗原受体 T 细胞治疗后的疗效
中枢神经系统原发性弥漫大 B 细胞淋巴瘤 (PCNSL) 是一种罕见但侵袭性强的淋巴瘤,通常局限于脑、脊髓、软脑膜、脑脊液和/或玻璃体视网膜空间,不影响全身。1,2 尽管随着治疗方法的不断发展,这些患者的预后有所改善,1 但一线治疗后未达到完全缓解 (CR)(即原发性难治性)的患者或在自体干细胞移植 (ASCT) 后复发的患者生存率较低。3 目前尚无关于这些患者最佳挽救治疗的共识,3 并且已采用不同的治疗策略并取得一定成功。3,4 针对 CD19 的嵌合抗原受体 T 细胞 (CAR-T) 疗法被批准用于治疗全身复发或难治 (R/R) 弥漫大 B 细胞淋巴瘤。 5-7 然而,这些关键试验并未纳入 PCNSL 患者,并且 PCNSL 患者被明确排除在 axicabtagene ciloleucel (axi-cel)、tisagenlecleucel (tisa-cel) 和 lisocabtagene maraleucel (liso-cel) 标签之外。8 自 CAR-T 在美国和欧洲获批以来,已有 4 项小型研究(患者数=5-27)报告了 CAR-T 在 PCNSL 中的初步活性和毒性,这些研究的随访时间相对较短。9-12 我们在此使用来自国际血液和骨髓移植研究中心登记处的数据,对 2019 年 1 月至 2022 年 3 月期间接受商业 CAR-T 细胞疗法的 R/R PCNSL 患者进行了分析。研究人群包括连续、同意的患者(≥18 岁),诊断为 R/R PCNSL,并在指数期间接受了市售 CAR T 细胞疗法(即 axi-cel 或 tisa-cel)。没有患者因年龄、合并症、产品类型或数据完整性而被排除。来自禁运中心的患者被排除在外。主要终点是总生存期 (OS),定义为从 CAR T 输注到因任何原因死亡的时间。次要终点包括第 100 天的总有效率 (ORR)、无进展生存期 (PFS)(定义为从 CAR-T 到复发/进展性疾病 (PD) 或因任何原因死亡的时间,以先发生者为准)、复发或进展的累积发生率、非复发死亡率 (NRM)、死亡原因、CAR-T 输注后第 30 天任何级别严重细胞因子释放综合征 (CRS) 和免疫效应细胞相关神经毒性综合征 (ICANS) 的累积发生率(ASTCT 标准 13 定义),以及中性粒细胞和血小板恢复情况。累积发生率函数用于估计复发/进展、NRM、CRS 和 ICANS,Kaplan-Meier 估计量用于
指南:原发性产后出血(PPH)
• 在当地可用的资源、专业知识和实践范围内提供护理 • 支持消费者权利和知情决策,包括拒绝干预或持续管理的权利 • 在适合文化并能够进行舒适和保密的讨论的环境中,为消费者提供选择建议。这包括在必要时使用口译服务 • 确保在提供护理前获得知情同意 • 满足所有法律要求和专业标准 • 在提供护理时采取标准预防措施,并在必要时采取额外预防措施 • 按照强制性和当地要求记录所有护理 昆士兰卫生部在法律允许的最大范围内,对因使用本指南而产生的任何费用、损失、损害和成本不承担任何责任和义务(包括但不限于疏忽责任),包括本文件中包含或提及的材料以任何方式不准确、脱离上下文、不完整或不可用。推荐引用:昆士兰临床指南。原发性产后出血 (PPH) 指南编号 MN24.1-V12-R29 昆士兰卫生部。2024 年。网址:http://www.health.qld.gov.au/qcg
发布日期:2024 年 11 月 19 日,英国伦敦 Linerixibat 在治疗原发性胆汁性胆管炎的胆汁淤积性瘙痒症(持续性瘙痒)方面显示出积极的 III 期结果
可导致肝功能衰竭的自身免疫性疾病 葛兰素史克公司 (LSE/NYSE: GSK) 今天宣布了 GLISTEN 的积极总体结果,GLISTEN 是正在进行的全球 III 期临床试验,评估了在研的回肠胆汁酸转运蛋白 (IBAT) 靶向抑制剂 linerixibat 对原发性胆汁性胆管炎 (PBC) 相关的胆汁淤积性瘙痒 (持续性瘙痒) 成人患者的作用,PBC 是一种罕见的自身免疫性肝病。GLISTEN 达到了其主要终点,使用 linerixibat 后瘙痒症状有所改善,与安慰剂相比,24 周内每月瘙痒评分与基线相比有统计学意义的降低。该试验招募了患有中度至重度瘙痒的 PBC 患者,这些患者正在接受稳定剂量的指南建议的瘙痒疗法、未接受过治疗或之前接受过治疗。初步安全性结果与之前对 linerixibat 的研究结果大体一致。这些数据的进一步分析正在进行中。 GSK 高级副总裁兼呼吸/免疫学研发全球主管 Kaivan Khavandi 表示:“Linerixibat 有可能成为全球首个专门为治疗 PBC 瘙痒而开发的疗法。这些积极的数据表明,它可以在支持那些生活质量因持续瘙痒而受到多方面严重影响的患者方面发挥作用。”到 2030 年,全球被诊断患有 PBC 的人将达到 510,000 人,超过 240,000 人将经历需要治疗的持续瘙痒,这是一个巨大的未满足需求。1,2,3,4 目前的指南建议,可用于治疗胆汁淤积性瘙痒的治疗方法不足,已知对瘙痒的影响有限,并且耐受性差。5,6 PBC 是一种罕见的胆管疾病,主要影响女性,如果不及时治疗,会导致肝损伤和可能的肝功能衰竭。最常见的症状之一是持续不断的瘙痒或皮肤蠕动感,以及疲劳感,夜间瘙痒通常会加剧这种感觉。这种疾病目前无法治愈。PBCers Organization 主席 Carol Roberts 表示:“对于许多患者来说,与 PBC 相关的瘙痒是持续不断的,而且通常很严重,但这种症状经常被忽视或忽略。它对 PBC 患者的生活质量和心理健康有重大影响。一种治疗瘙痒根本原因的治疗方案的潜力可以满足原发性胆汁性胆管炎患者以前未得到满足的需求。” GLISTEN 的全部结果将在未来的科学大会上公布。Linerixibat 目前尚未在世界任何地方获得批准;它已在美国和欧盟获得孤儿药资格。关于原发性胆汁性胆管炎中的胆汁淤积性瘙痒在原发性胆汁性胆管炎 (PBC)(一种胆汁淤积性肝病)中,来自肝脏的胆汁流被中断。由此产生的循环中过量的胆汁酸被认为是胆汁淤积性瘙痒的因果关系,胆汁淤积性瘙痒是一种无法通过抓挠缓解的内部瘙痒。瘙痒可发生在 PBC 疾病的任何阶段,多达 90% 的 PBC 患者都会经历瘙痒。4 PBC 的一线治疗可控制约 70% 患者的疾病,但不会减轻瘙痒的严重程度或影响。7 胆汁淤积性瘙痒是一种严重的疾病,可能
基因调节网络从原发性CD4+ TCELL中的CRISPR扰动中的推断阐明了免疫疾病的基因组基础
Joshua S. Weinstock,1,2,15 Maya M. Arce,3,4,15 Jacob W. Freimer,2,3 Mineto Ota,2,3 Alexander Marson,3,4,5,6,7,7,8,8,9,9,9,9,14美国马里兰州巴尔的摩约翰·霍普金斯大学生物医学工程系2遗传学系,斯坦福大学,斯坦福大学,美国加利福尼亚州94305,美国3 Gladstone-UCSF基因组免疫学研究所,旧金山,CA 94158,美国加利福尼亚大学,加利福尼亚大学,旧金山94158加利福尼亚大学伯克利分校,加利福尼亚州伯克利分校,美国6日64720,6人类遗传学研究所(IHG),加利福尼亚大学,旧金山,旧金山,旧金山,加利福尼亚州94143,美国7帕克癌症癌症治疗研究所,加利福尼亚大学,加利福尼亚大学,旧金山,旧金山,美国,美国944112,旧金山,旧金山,CA 94143,美国9 UCSF Helen Diller家庭综合癌症中心,加利福尼亚大学,旧金山,旧金山,旧金山,加利福尼亚州94158,美国10马龙医疗保健中心,医疗保健中心约翰·霍普金斯大学,巴尔的摩,马里兰州,美国13号生物学系,斯坦福大学,加利福尼亚州斯坦福大学,14高级作者15这些作者同样贡献了16个铅联系 *通信 *通讯:alex.marson@gladstone.ucsf.edu(A.M。)),pritch@stanford.edu(J.K.P。)https://doi.org/10.1016/j.xgen.2024.100671https://doi.org/10.1016/j.xgen.2024.100671
针对原发性精神病患者抗精神病药物和 ADHD 药物联合治疗的国家临床建议
建议理由 要考虑将 ADHD 药物作为附加治疗,患者必须临床状况稳定并且原发性精神病得到良好的管理。稳定是指症状和功能水平没有显著波动,包括最近没有住院治疗。管理良好是指由于适当的抗精神病治疗,精神病症状得到显著缓解。不需要完全缓解精神病症状。托莫西汀是一线治疗药物。胍法辛是儿童/青少年和成人的替代治疗方法(仅次于托莫西汀),因为其与抗精神病药物联合使用的疗效高度不确定。莫达非尼是成人的替代治疗方法(仅次于托莫西汀和可能的胍法辛),因为在丹麦没有使用莫达非尼治疗一般注意力障碍的经验,而且其使用与严重皮肤表现的个别病例有关。因此,不应给儿童开莫达非尼。由于根据审查的证据,益处和有害影响之间的平衡尚不明确,因此个体临床因素将决定在确定的目标群体中哪些选定的患者可能适合接受托莫西汀(或胍法辛/莫达非尼)的试验。这些个体临床因素将基于对特定患者和药物的了解,其中可能包括诸如遵守更复杂药物治疗方案的可能性、患者当前的生活状况以及其直接网络中可用于支持辅助治疗的支持等考虑因素。先前被诊断患有 ADHD 并接受过兴奋剂药物治疗且耐受性良好的患者构成了一个特殊群体,如果托莫西汀(可能还有胍法辛)无法达到足够的效果,则可以考虑使用哌甲酯治疗。在这种特殊情况下,如果选择开始使用哌甲酯进行辅助治疗,应注意产品信息将治疗列为精神病或精神分裂症患者的禁忌症。然而,在制定这项国家临床建议的过程中审查的最新观察性研究并未证实症状恶化的风险(以精神病住院风险衡量)。其他兴奋剂药物(右旋安非他明和赖右安非他明)很少具有相关性,因为它们具有更强的兴奋作用,并且可能增加精神病恶化的风险。未接受抗精神病治疗的精神分裂症或其他原发性精神病患者不在本国家临床建议的范围内,因为这类人群未包括在证据库中。证据库中没有患者被诊断患有 ADHD/ADD。除注意力之外,其他认知领域的障碍也包括在本建议中。在未被诊断患有 ADHD/ADD 的患者中,使用 ADHD 药物进行辅助治疗属于标签外治疗,应告知患者该治疗超出了批准的适应症,并且包装说明书中不会显示该适应症。在丹麦,莫达非尼未获准用于治疗 ADHD。
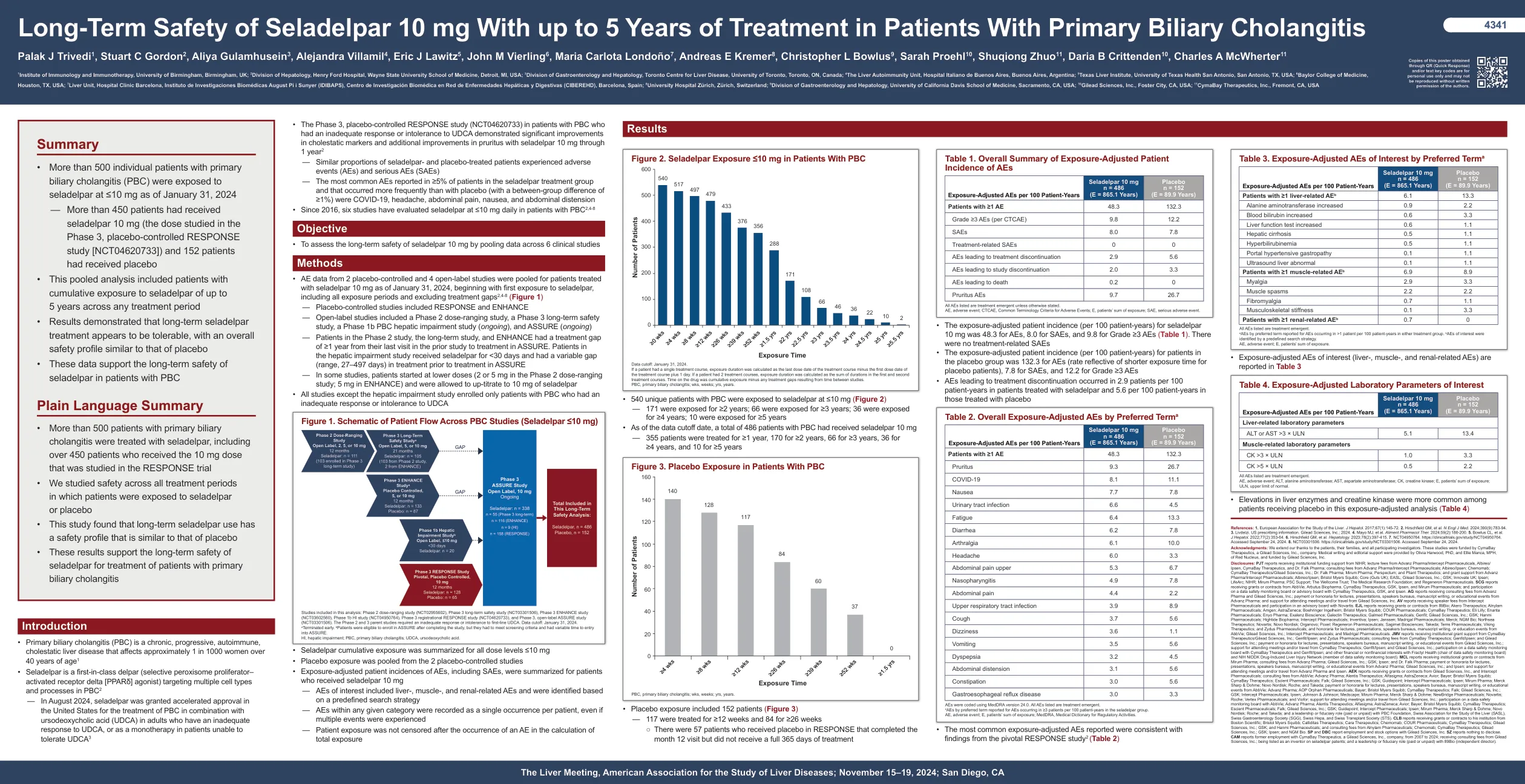
Seladelpar 10 毫克治疗原发性胆汁性胆管炎患者长达 5 年的长期安全性
— 安慰剂对照研究包括 RESPONSE 和 ENHANCE — 开放标签研究包括第 2 阶段剂量范围研究、第 3 阶段长期安全性研究、第 1b 阶段 PBC 肝功能损害研究(进行中)和 ASSURE(进行中) — 第 2 阶段研究、长期研究和 ENHANCE 中的患者从他们在前一项研究中的最后一次就诊到 ASSURE 治疗之间的治疗间隔为 ≥1 年。肝功能损害研究中的患者接受 seladelpar 治疗的时间不到 30 天,在 ASSURE 治疗之前的治疗间隔各不相同(范围为 27-497 天) — 在一些研究中,患者从较低剂量开始(第 2 阶段剂量范围研究中为 2 或 5 毫克;ENHANCE 中为 5 毫克),并被允许将 seladelpar 剂量上调至 10 毫克 • 除肝功能损害研究外,所有研究均仅招募患有
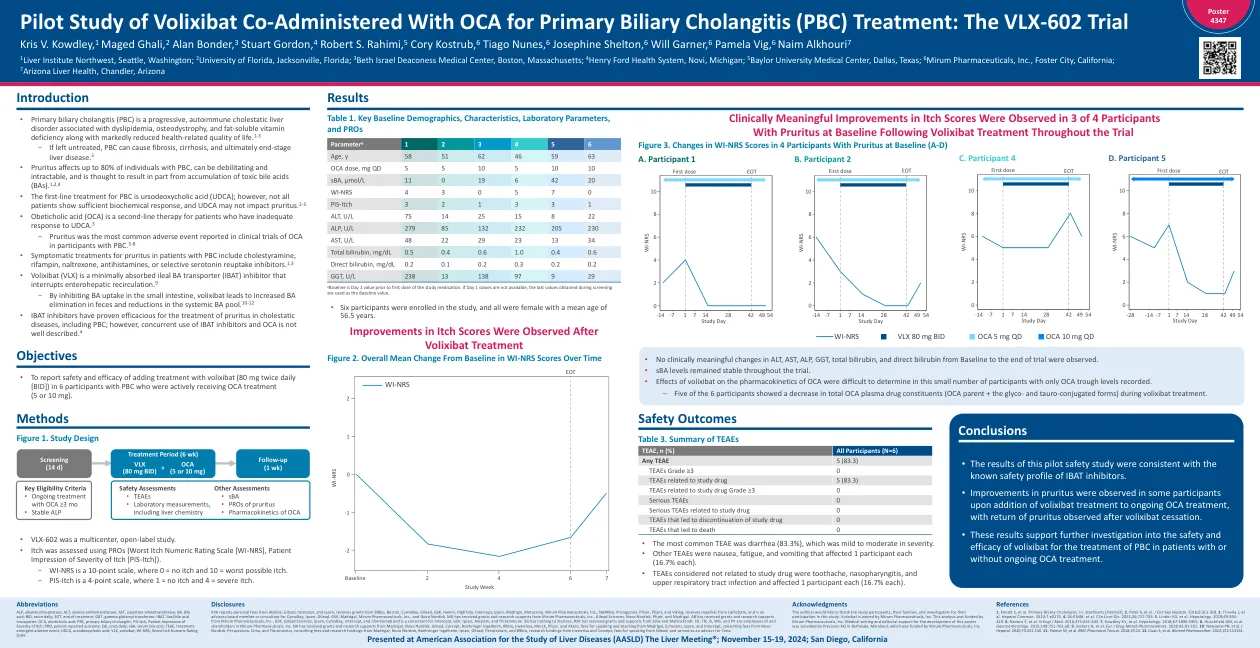
Volixibat 与 OCA 联合用药治疗原发性胆汁性胆管炎 (PBC) 的初步研究:VLX-602 试验
KVK 报告称,他从 AbbVie、Gilead、Intercept 和 Ipsen 收取个人费用,从 89bio、Boston、CymaBay、Gilead、GSK、Hanmi、HighTide、Intercept、Ipsen、Madrigal、Metacrine、Mirum Pharmaceuticals, Inc.、NGMBio、Protagonist、Pfizer、Pliant 和 Viking 获得资助,从 UpToDate 获得版税,并且是 CymaBay、Ipsen、Gilead、GSK、Madrigal、Mirum Pharmaceuticals, Inc. 和 Novo Nordisk 的顾问委员会成员或顾问。MG 已从 Mirum Pharmaceuticals, Inc.、Gilead Sciences、Novo Nordisk、Pfizer 和 Madrigal 获得资助和研究支持。 AB 已获得 Mirum Pharmaceuticals, Inc.、GSK、Gilead Sciences、Ipsen、CymaBay、Intercept 和 Chemomab 的资助和研究支持,并且担任 Intercept、GSK、Ipsen、Alnylam 和 Thirammune 的顾问。SG 没有任何可披露的信息。RSR 已获得 Salix 和 Mallinckrodt 的资助和支持。 CK、TN、JS、WG 和 PV 是 Mirum Pharmaceuticals, Inc. 的员工和股东。NA 曾获得 Madrigal、Novo Nordisk、Gilead、Corcept、Boehringer Ingelheim、89bio、Inventiva、Merck、Pfizer 和 Akero 的资助和研究支持,获得 Madrigal、Echosens、Ipsen 和 Intercept 的演讲和教学费用,获得 Novo Nordisk、Perspectum、Cima 和 Fibronostics 的咨询费,获得 Madrigal、Novo Nordisk、Boehringer Ingelheim、Ipsen、Gilead、Perspectum 和 89bio 的咨询费和研究经费,获得 Inventiva 和 Corcept 的研究经费,获得 Gilead 的演讲费用,并担任 Cima 的顾问。