XiaoMi-AI文件搜索系统
World File Search Systempembrolizumab在手术前进行化学疗法(...
3.1可切除的非小细胞肺癌(NSCLC)的标准护理是具有化学疗法和外科切除术的新辅助Nivolumab(从现在开始,Neoadjuvant Nivolumab)。其他治疗方案包括新辅助化学疗法和通过癌症药物基金(CDF)进行或不进行维持的辅助化学疗法。可切除的NSCLC通常是早期或局部晚期癌症,不包括3C期。手术可以治愈癌症,但复发很常见,可以是局部区域(在肺部和附近的淋巴结中)或远处转移(身体的其他部位)。患者组织提交报告说,手术后NSCLC的复发通常意味着不太可能进行进一步的治疗治疗。它解释说,判断手术是否治愈的唯一方法是等待,这会导致病情及其家人及其家人和护理人员的持续焦虑。患者组织
分析新辅助修饰的folfirinox治疗的可切除胰腺癌中血浆循环肿瘤DNA的分析:临床相关性o
先前的研究进行了血浆CTDNA分析,以评估几种类型的癌症中新辅助化学其他疗法的临床结果[10-12]。但是,对于与新辅助治疗治疗的BRPC患者结果相关的生物标志物的证据只有有限的证据,而其他血浆CTDNA分析可能会发现潜在的生物标志物来指导BRPC患者的管理。在这项研究中,我们进行了血浆CTDNA分析,以在我们的2阶段临床试验(ClinicalTrials.gov识别仪:NCT02749136)中搜索接受新辅助MFOLFIRINOX治疗的BRPC患者的潜在生物标志物。对DNA损伤修复(DDR)途径涉及的基因的改变以及对新辅助Mfolfirinox的反应主要研究了,因为先前的几项研究表明,胰腺癌对胰腺癌的钙数字敏感性在BRCA1,BRCA1,BRCA2和PALBB中具有种系变量[13,14] [13,14]。
针对 II-IIIB 期可切除非小细胞肺癌患者的精准新辅助治疗的开放标签前瞻性 II 期伞状研究的研究方案(目的)
方法/设计:本研究是一项开放标签、前瞻性、II 期伞状试验,入组了确诊为未接受治疗的潜在可切除的 II-IIIB 期 NSCLC 患者。使用 68 个基因组合对符合条件患者的肿瘤组织活检进行新一代测序(NGS)。然后根据肿瘤组织中基因突变状态和 PD-L1 状态将入组患者分成 6 个独立队列,即:①EGFR 19del 组,②EGFR 21 L858R 组,③EGFR 罕见突变组,④其他驱动突变组,⑤驱动突变阴性组(PD-L1 ≥ 1%),⑥驱动突变阴性组(PD-L1<1%)。每个队列独立进行 Simon 两阶段设计,患者分别接受相应的标准疗法。我们计划每组招募 26 名患者,总共招募 156 名患者。主要终点是客观缓解率 (ORR)。次要终点包括肿瘤学预后和围手术期结果。探索性终点是研究患者特异性微小残留病 (MRD) 在预测治疗效果和肿瘤学预后方面的作用。
胰腺癌新辅助治疗的未来方向
尽管付出了巨大的努力,成功治疗胰腺癌 (PCa) 仍然是一项重大挑战 [1]。找到重新编程肿瘤微环境中动态肿瘤促进相互作用的方法将有助于通过比传统化疗更有效、毒性更小的方法来改善这种可怕的疾病(图 1)[2]。在过去十年中,新辅助疗法与传统化疗相结合已显著改善了包括 PCa 在内的局部晚期肿瘤的预后 [3-5]。事实上,多达 60% 的局部晚期 PCa 患者在接受新辅助化疗后可切除 [6],可切除 PCa 的新辅助治疗的初步结果令人鼓舞 [7]。到目前为止,PCa 的新辅助治疗并不采用分子靶向疗法,而是采用 FOLFIRINOX 等经典方案,但依赖于基质白蛋白受体可用性的白蛋白结合型紫杉醇除外。在其他肿瘤实体中提供持久反应的分子靶向疗法在 PCa 中并未产生预期结果 [8]。以免疫检查点抑制剂 (ICI) 和癌症疫苗为首的癌症免疫疗法已在许多实体恶性肿瘤中显示出显著的长期疗效 [9]。免疫疗法在 PCa 上取得的成功有限,主要是由于肿瘤突变负担低和存在
MD Anderson在SSO 低血糖管理 白血病见解2024年1月 临床管理 - 肺炎 - web-algorithm.pdf ABC临床试验清单 肺栓塞反应团队(PERT) 慢性淋巴细胞性白血病 - 下一步 第1页,共8页免责声明:该算法是为MD Anderson开发的。 不公开和保密协议 Waldenstrom的巨球蛋白血症 心脏成功:对于心力衰竭和癌症的患者 RPPA描述 高血糖应急管理(DKA/EDKA/HHS) PA奖学金手册2025 MD Anderson住宿列表 - 其他 头部和颈部肿瘤学 校友故事-Ashutosh Rao
介绍:ON:PA:具有可切除的双龙结直肠癌肝转移的ENTS - 次前手术与分子引导的新辅助化疗4:41-41-4:50前手术Brian Bednarski,医学博士4:52-4:54 pm。 Rebujal:前期手术4:00-5:00居民/其他编程:海报出席:ONS室124-1254:52-4:54 pm。 Rebujal:前期手术4:00-5:00居民/其他编程:海报出席:ONS室124-125
BC癌症协议摘要 - 新辅助...
资格:患者必须具有:可切除的皮肤,丙氨酸或粘膜黑色素瘤,临床可检测到的临床可检测到的淋巴结疾病,或者在介绍时可切除的转移性疾病有限[即IIIB到IIIB或IIIIS或IIII IIIIS或IIIIS或寡聚期IV期IV期IV(M1A,M1B和M1B和M1C)的效果(M1B和M1B)的疗法,并疗法为8 th the Edition and untist and untist and Edition],并且是Edition and Edities。足够的基线血液学,肝功能和肾功能进入具有管理免疫疗法的专业知识的治疗中心介导的Pembrolizumab的毒性,pembrolizumab的毒性注释:pembrolizumab的三个周期应在术前进行术前接受(新辅助治疗阶段),除非需要进行6个周期的临床批准,否则需要进行临床批准,否则需要进行临床批准,否则需要进行临床批准。 pembrolizumab术后(辅助治疗阶段)。Do not switch to 6- weekly dosing during neoadjuvant treatment phase Patients may have subsequent checkpoint inhibitors for advanced disease if last adjuvant pembrolizumab dose was > 6 months prior EXCLUSIONS: Patients must not have: Uveal or ocular melanoma CAUTIONS: Concurrent autoimmune disease Patients with long term immunosuppressive therapy or systemic corticosteroids (requiring超过10 mg泼尼松/天或同等的)
列表 - 兼容性使用程序。 ...
活性物质L19IL2(抗体L19与人IL-2的偶联形式)和L19TNF(抗体L19与人TNFα相连均匀格式)的药物形式的溶液在全周内施用了一个每周一次的Indiment Indiment Indiment Indiment Indy Indy Ind in in Ind uccy in 13 mio IUC9 lif l19 lif 2 lif2肿瘤病变4周,指示新辅助治疗局部晚期可切除的黑色素瘤的成年患者,这些患者不适合辅助系统治疗的确认通知日期
肿瘤学临床途径 - 恶性黑色素瘤
新辅助pembrolizumab对新辅助免疫疗法的使用应考虑到某些患者的临床状况和立即切除的临床状况;在随机的II期SWOG SWOG S1801研究中,由3剂术前的pembrolizumab组成的新辅助免疫疗法与患有临床或射线照相术和可切除期III和IV期黑色素瘤的患者的事件无生存的显着改善有关;对于某些患者讨论后,这种方法可能是合理的,但尚未与总体生存的改善有关,并且尚未以这种方式批准FDA
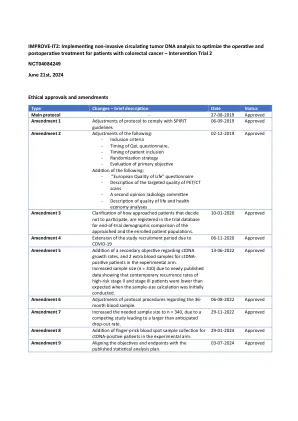
REVIT-IT2:实施非侵入性循环肿瘤DNA分析,以优化Colorect
内发生转移最常见于肝脏和肺部,如果以治愈性为例,则5年的相对存活率约为50-60%。2–5但是,如果检测到预期治疗的转移量为时已晚,而患者接受姑息化疗或最佳支持,那么5年后,少于10%的人还活着。 2–4,6–8切除和切除后的存活能力受到增加的转移部位和转移大小的负面影响。 2,3,5因此,当肿瘤负担低的时候早期发现复发是至关重要的,不仅是为了提高治愈性切除率,而且还可以增加切除后的生存率。 转移的局部治疗(例如 射频消融)很小,但在不符合大手术的患者中不可切除或可能可切除,其生存率高达40-60%。 9–12这意味着,也认为被认为没有符合治疗切除的患者可能会受益于早期复发检测。2–5但是,如果检测到预期治疗的转移量为时已晚,而患者接受姑息化疗或最佳支持,那么5年后,少于10%的人还活着。2–4,6–8切除和切除后的存活能力受到增加的转移部位和转移大小的负面影响。2,3,5因此,当肿瘤负担低的时候早期发现复发是至关重要的,不仅是为了提高治愈性切除率,而且还可以增加切除后的生存率。转移的局部治疗(例如射频消融)很小,但在不符合大手术的患者中不可切除或可能可切除,其生存率高达40-60%。9–12这意味着,也认为被认为没有符合治疗切除的患者可能会受益于早期复发检测。