XiaoMi-AI文件搜索系统
World File Search System批准后试验与患者注册表:晚期黑色素瘤患者患有脑转移的可比性Ismail,R.K。;锡克斯(N.O);武器,
批准后试验和患者注册机构在生成后批准数据中具有优缺点。目前,黑色素瘤患者目前存在这些数据源的临床结果之间的直接比较。我们旨在调查患者注册表是否可以补充甚至替换批准后试验。使用了来自药品评估委员会的单臂临床试验数据,并使用了来自荷兰黑色素瘤治疗注册中心的现实世界数据。研究人群由一线靶向疗法(BRAF-或BRAF-MEK抑制剂)治疗的脑转移晚期黑色素瘤患者组成。使用COX危害回归模型和倾向评分匹配(PSM)模型比较两个患者人群。与在批准后试验中接受治疗的患者相比(n = 467),现实世界患者(n = 602)的年龄明显更高,ECOG性能状况更高,≥3个器官受累和更多症状性脑转移。乳酸脱氢酶水平相似。在现实世界患者中,未经调整的中值总生存期(MOS)为8.7(95%CI,8.1-10.4)个月,而实际患者为7.2(95%CI,6.5-7.7)月(P <0.01)。使用Cox危险回归模型,对预后因素进行了调整,这导致了MOS的统计差异和8.7(95%CI,7.9-10.4)月的现实世界患者的统计差异,而分别为7.3(分别为95%CI,6.3-7.9)。PSM模型产生了310名与生存相似的匹配的患者(p = 0.9)。注册表可以是两个数据源的临床结果相似。
在先进治疗药物的可比性考虑方面面临哪些质量挑战?
先进疗法委员会 (CAT) 于 2019 年 12 月发布的题为“问答、先进疗法药物的可比性考虑”的文本包含了公司在需要比较 ATMP 制造工艺变更前后的情况时可能遇到的主要问题。答案基于在频繁进行实验变化的情况下所需的分析和统计工具。一般来说,该文本解决了与证明 ATMP 质量方面的可比性相关的问题。另一个重要文本是 ICH Q5E 指南,该指南涉及生物/生物技术药物的可比性。但是,除了可以应用于 ATMP 的一般原则外,ATMP 不在本指南的范围内。
定义地热领域的 LCA 指南以增强结果可比性
1 意大利锡耶纳大学生物技术、化学和药学系 R2ES 实验室,53100 锡耶纳,意大利;marialaura.parisi@unisi.it(MLP);tosti@csgi.unifi.it(LT)2 胶体和表面科学中心(CSGI),50019 佛罗伦萨,意大利;barbara.mendecka@unifi.it(BM);daniele.fiaschi@unifi.it(DF);giampaolo.manfrida@unifi.it(GM)3 巴黎高科矿业大学,PSL 大学,观察、影响和能源中心(OIE),06904 Sophia Antipolis Cedex,法国;melanie.douziech@mines-paristech.fr(MD); paula.perez_lopez@mines-paristech.fr (PP-L.) 4 佛罗伦萨大学工业工程系,50135 佛罗伦萨,意大利 5 那不勒斯帕特诺佩大学科学技术系,80133 那不勒斯,意大利 * 通讯地址:sergio.ulgiati@uniparthenope.it (SU); isabelle.blanc@mines-paristech.fr (IB)
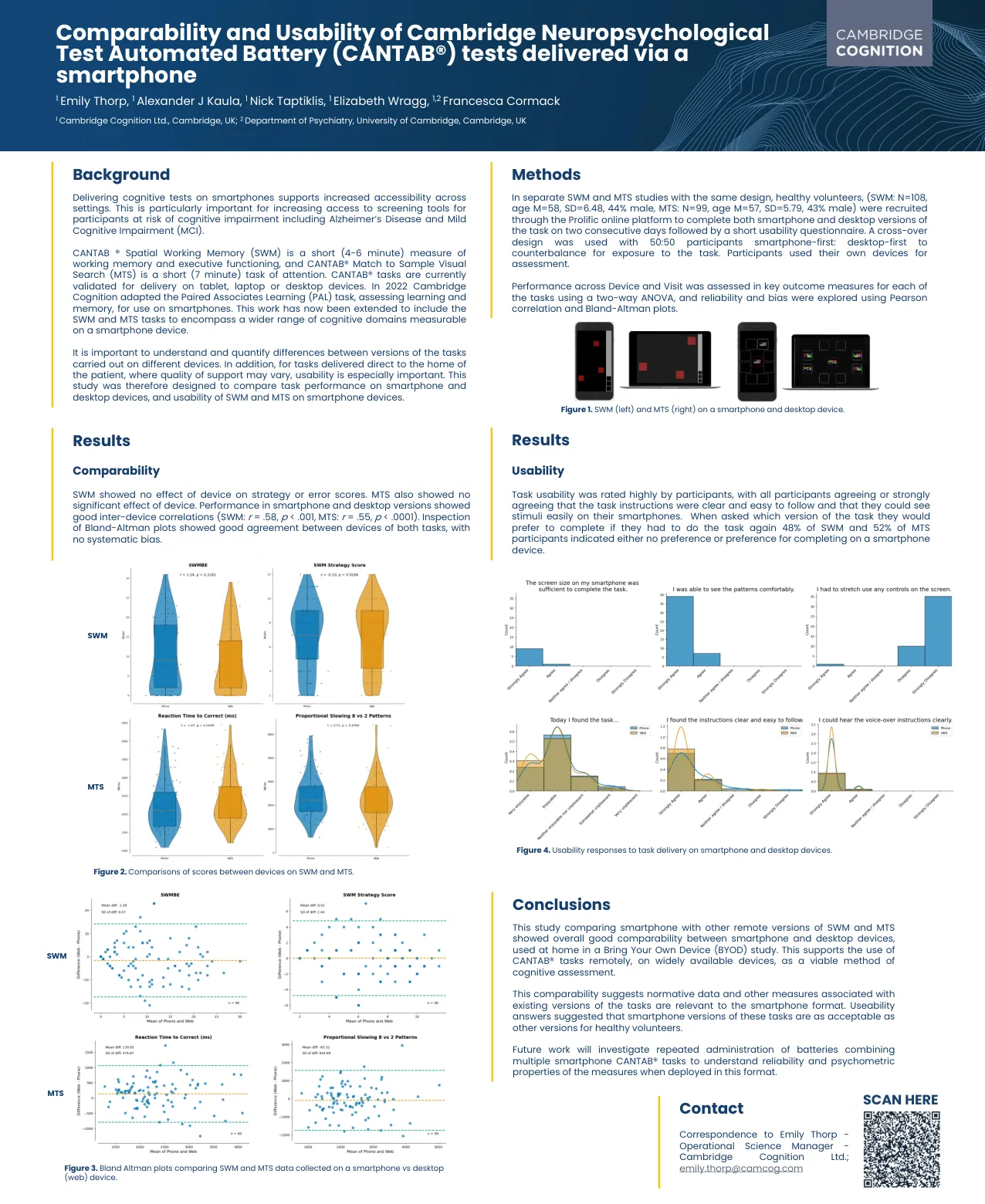
通过智能手机进行的剑桥神经心理学测试自动化电池 (CANTAB®) 测试的可比性和可用性
CANTAB ® 空间工作记忆 (SWM) 是一种短时间(4-6 分钟)的工作记忆和执行功能测量方法,而 CANTAB® 匹配样本视觉搜索 (MTS) 是一种短时间(7 分钟)的注意力任务。CANTAB® 任务目前已验证可在平板电脑、笔记本电脑或台式机设备上执行。2022 年,Cambridge Cognition 改编了配对联想学习 (PAL) 任务,用于评估学习和记忆,供智能手机使用。这项工作现已扩展到包括 SWM 和 MTS 任务,以涵盖可在智能手机设备上测量的更广泛的认知领域。
细胞和基因治疗产品2024建立细胞治疗产品可比性的方法
“这些复杂产物的可比性程序不能仅基于与纯度有关的表型标记的表征,从而确认了异质性产品反映其新陈代谢,分化阶段,结构组织和相互作用的动态性质应成为可比性评估的一部分” -EMA/CAT/499821/2019
案例研究具有IPSC衍生的基因组的可比性...
不包括可比性:•HPC过程中的指标,释放和稳定性(变化的上游)•对可比性演示批次(NA - 实验室产生)未执行的某些测试(*)•DP稳定性未执行可比性(但包括每年的稳定性1批次)
标题:BACTEC方法的验证和可比性...
不育测试是CAR -T(嵌合抗原受体T细胞)疗法的批处理释放过程中的重要和关键步骤。CAR -T疗法涉及基因工程患者自己的T细胞靶向和破坏癌细胞。这些疗法通常用于治疗患有严重癌症的患者,尤其是血液学恶性肿瘤。鉴于CAR -T治疗的高度专业化和接受它们的患者的免疫功能低下的状态,确保这些疗法的无菌性至关重要。与典型的方式不同,细胞和基因疗法是生命最终产品。但是,区分所需的活细胞(例如T细胞)和不希望的成分(例如细菌,真菌)至关重要。This is especially vital for autologous CAR‐T cells therapies as each small batch must be tested due to limited volume, and rapid testing is essential to ensure timely delivery for patient treatment (Source: https://www.pharmtech.com/view/contamination‐control‐for‐cell‐and‐gene‐therapies‐needs‐ new‐analytics).该行业使用的标准参考是汇编不育测试,涉及将微生物直接接种到培养基中(Ph.Eur。第2.6.1章和USP <71>)。此方法需要14天,并因其遵守监管标准和可靠性而被该行业认可。
表 3:可比性方法 - 重点关注细胞和……
工艺变更(即生产地点/规模、配方、加工步骤……)是细胞和基因治疗产品在开发期间和批准后生产生命周期中不可或缺的一部分。这些变化通常会影响产品质量属性。可比性练习的目标是确保所做的更改不会对药物的质量、安全性和功效产生不利影响。通常,会进行风险评估以评估变更对与安全性和功效相关的产品质量的潜在影响,并告知适当的可比性策略。新的 FDA 指南草案“人类细胞和基因治疗产品的生产变更和可比性”提供了在生产过程发生变化之前和之后评估细胞和基因治疗产品可比性的原则。本次圆桌会议旨在讨论细胞和基因治疗可比性练习的方法、最佳实践和监管期望。
核酸分析CGE 微生物挑战范围内研究 细胞和基因治疗产品2024 建立细胞治疗产品可比性的方法
○除了上述:pH,浓度和效力,以及诸如残留蛋白质,基因组/模板DNA,NTPS和DSRNA等过程中的杂质○可以通过IPRP-UV和/或CGE-LIF的CGE-LIF评估最重要的CQA:最重要的CQA之一:
人类细胞和基因治疗产品的制造变更和可比性;行业指南草案
本指导文件仅供评论之用。请在《联邦公报》上公布指导草案的日期之前,提交一套电子或书面意见。电子意见提交至 http://www.regulations.gov。书面意见提交至食品药品管理局卷宗管理人员(HFA-305),地址:5630 Fishers Lane, Rm. 1061, Rockville, MD 20852。所有意见都应在《联邦公报》上公布的可用性通知中列出卷宗编号。可从通信、推广和发展办公室(OCOD)获取本指导的更多副本,地址:10903 New Hampshire Ave., Bldg. 71, Rm. 3128, Silver Spring, MD 20993-0002,或致电 1-800-835-4709 或 240-402-8010,或发送电子邮件至 ocod@fda.hhs.gov,或通过互联网访问 https://www.fda.gov/vaccines-blood-biologics/guidance-compliance-regulatory-information-biologics/biologics-guidances。如对本指南内容有疑问,请通过上述电话号码或电子邮件地址联系 OCOD。