XiaoMi-AI文件搜索系统
World File Search System重组dictyostelium Discoideum DNA聚合酶Epsilon亚基3(POL3)
重建,我们建议在打开之前对此小瓶进行简短离心,以使内容达到底部。请在去离子无菌水中重新构建蛋白质,浓度为0.1-1.0 mg/ml。我们建议在-20°C/-80°C下加入5-50%的甘油(最终浓度)和等分试样。我们默认的甘油最终浓度为50%。客户可以将其用作参考。
重组爱泼斯坦 - 巴尔病毒DNA聚合酶催化亚基(BALF5),部分
重建,我们建议在打开之前对此小瓶进行简短离心,以使内容达到底部。请在去离子无菌水中重新构建蛋白质,浓度为0.1-1.0 mg/ml。我们建议在-20°C/-80°C下加入5-50%的甘油(最终浓度)和等分试样。我们默认的甘油最终浓度为50%。客户可以将其用作参考。
TAQ DNA聚合酶与热植物II(...
聚合酶链反应(PCR)是一种强大而敏感的DNA扩增技术(1)。TAQ DNA聚合酶是PCR广泛使用的酶(2)。提供了以下准则,以确保使用新英格兰的成功PCR
聚合酶参与线粒体DNA维持...
摘要:由活性氧(ROS)触发损坏的线粒体DNA(mtDNA),迄今为止了解到MTDNA维持的过程鲜为人知,这些过程与DNA修复,DNA降解和DNA复制之间的复杂相互作用协调。这项研究旨在通过应用特殊的远程PCR,反映MTDNA完整性,以识别MTDNA维持中涉及的蛋白质。在强制氧化磷酸化的条件下,对基于文献的候选者进行了siRNA筛查,揭示了聚合酶的功能群及其中的聚合酶ζ(POLZ)作为最高命中率。因此,Polz敲低引起mtDNA积累,这需要基础切除修复(BER)核酸酶APE1的活性,然后由单细胞线粒体原位杂交方案(MTRIP)确定的代偿性mtDNA复制。线粒体中的活性氧(ROS)揭示了Polz在次要弧区域形成典型缺失的额外的,无ROS的参与。与证明Polz在线粒体中定位的数据一起,我们建议Polz在mtDNA周转率中起着重要作用,尤其是在氧化应激条件下。
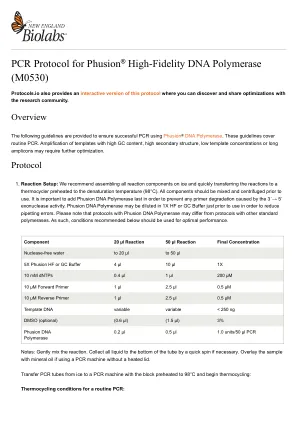
PCR 方案 Phusion® DNA 聚合酶
少于 20 个核苷酸,应使用与下引物 T 相等的退火温度。也可以使用温度梯度来优化每个引物对的退火温度。对于两步循环,梯度
Taq DNA 聚合酶的 PCR 方案
聚合酶链式反应 (PCR) 是一种功能强大且灵敏的 DNA 扩增技术 (1)。Taq DNA 聚合酶是一种广泛用于 PCR 的酶 (2)。以下指南旨在确保使用 NEB 的 Taq DNA 进行 PCR 成功
RADA和DNA聚合酶在重组中的作用 - ...
摘要:背景:使用基因组数据,我们确定了MRSA ST398分离株的起源,该分离物是无知的牲畜接触患者的侵入性感染。方法:我们使用Illumina Technique测序了2013年至2017年之间具有侵入性感染患者的七个MSSA和四种MRSA ST398分离株的基因组。预言相关的毒力基因和耐药基因。为了确定分离株的起源,其基因组序列被包括在系统发育分析中,还包括NCBI上可用的ST398基因组。结果:所有分离株都带有ϕ SA3预言,但是免疫逃避簇的变化:MRSA分离株中的C型,MSSA分离株中的B型B型。所有MSSA都属于SPA Type T1451。MRSA菌株具有相同的SCC MEC类型IVA(2B)盒式盒子,属于SPA型T899,T4132,T1939和T2922。所有MRSA都携带四环素抗性基因TET(M)。系统发育分析表明,MSSA分离株属于人类相关的分离株,而MRSA分离株属于含有牲畜相关的MRSA的簇。结论:我们表明临床分离株MRSA和MSSA ST398具有不同的起源。通过牲畜相关的MRSA分离株对毒力基因的获取使它们能够在人类中诱导侵袭性感染。
重组易错DNA聚合酶(dnaE2),部分
序列 MSWDDAIEGV DRDTPGGRMP RAWNVAARLR AANDDISHAH VADGVPTYAE LHCLSDFSFL RGASSAEQLF ARAQHCGYSA LAITDECSLA GIVRGLEASR VTGVRLIVGS EFTLIDGTRF VLLVENAHGY PQVCGLVTTA RRAASKGAYR LGRADVEAQF RDVAPGVFAL WLPGVQPQAE QGAWLQQVFG ERAFLAVELH REQDDGARLQ VLQALAQQLG MTAVASGDVH MAQRRERIVQ DTLTAIRHTL PLAECGAHLF RNGERHLRTR RALGNIYPDA LLQAAVALAQ RCTFDISKIS YTYPRELVPE GHTPTSYLRQ LTEAGIRKRW PGGITAKVRE DIEKELALIA LKKYEAFFLT过程RVRERMQGKG YASTFIDQIF EQIKGFGSYG FPQSHAASFA KLVYASCWLK RHEPAAFACG LLNAQPMGFY SASQIVQDAR RGSPERERVE VLPVDVVHSD WDNTLVGGRP WRSAADPGEQ PAIRLGMRQV AGLSDVVAQR IVAARTQRAF ADIGDLCLRA ALDEKACLAL AEAGALQGMV GNRNAARWAM AGVEARRPLL PGSPEERPVA FEAPHAGEEI LADYRSVGLS LRQHPMALLR PQMRQRRILG LRDLQGRPHG SGVHVAGLVT QRQRPATAKG TIFVTLEDEH GMINVIVWSH LALRRRRALL ESRLLAVRGR WERVDGVEHL IAGDLHDLSD LLGDMQLPSR DFH
开发经过验证的定量聚合酶链反应测定和真菌培养物,用于诊断Budgerig中的大型Ornithogaster
胃。4个临床体征包括反流,腹泻,体重减轻,以及通常是猝死。3,4,6,9的组织学变化可以包括预脑炎,粘膜增生和腺体发育不良。5也已记录了MO感染与预脑脑腺癌之间的关联。5个可变的粪便脱落使得对虫的MO诊断具有挑战性。最常见的原反长期诊断是粪便的显微镜检查,包括直接湿坐骑,革兰氏染色,Romanowsky污渍,宏观求和技术和迷你链球菌技术。1,3,4,7,9,11,12但是,这些微观技术有局限性。微观诊断需要完整的MO生物体,这些生物可能并不总是显而易见的。间歇性脱落还可以排除受感染鸟类中生物体的粘性。7此外,可能会误认为碎屑和大的丝状,革兰氏阳性细菌,而这种生物并不总是染色或固定在幻灯片上。3,4,13,以帮助应对这些挑战,最近使用了泄殖腔拭子和粪便的PCR。PCR有许多优势:它可以从少量DNA中检测到MO,它不需要完整的生物进行诊断,并且与微观粪便相比,它具有提高的诊断敏感性。3,7在一项研究中,来自MO感染的Budgerigars的7个常规PCR诊断MO的可能性是粪便革兰氏染色的2.38倍。4但是,这些该生物的18S rRNA和结构域D1/D2区域最初用于从本质上鉴定为酵母。14已使用嵌套和半固定的PCR方法进行了传统的PCR,以放大该D1/D2区域,18S rRNA,内部转录垫片和日本宠物鸟类粪便中的1个区域。15粪便PCR可以具有限制,包括细菌DNA降解和粪便抑制剂16;但是,这种诊断有能力提供一种简单的无创方法来测试MO的鸟类,尤其是在大型鸟类环境中。除了显微镜和分子诊断外,MO培养还进行了培养,但由于特定和挑剔的生长需求而具有挑战性。17在传统真菌媒体上培养Mo的努力并没有成功,但是在微型自毒环境中,MO已成功地使用特定媒体和某些环境条件进行了培养。17根据文献,目前尚无研究表明MO已在培养中维持,或者已经进行了广泛的反抗易感性测试。实际上,没有私人实验室和美国类型文化收藏(ATCC)具有可用的MO文化。无法维持可持续的文化对发病机理,抗真菌敏感性和系统发育多样性的研究有限。由于某些设施中的鸟类发病率高和差异率很高,因此需要有效的MO治疗选择。常用的治疗方法包括两性霉素B(通过口腔膨胀或饮用水),苯甲酸钠(通过饮用水)和Nystatin(通过饮用水)。