XiaoMi-AI文件搜索系统
World File Search System新西兰数据表1。产品名称Avonex®Interferon Beta-1A(RCH)用于注射预填充注射器Avonex®Interferon Beta-1A(RCH)
新西兰数据表1。产品名称Avonex®Interferon Beta-1A(RCH)溶液用于注射预填充注射器Avonex®Interferon beta-1a(RCH)溶液用于注射笔2。定性和定量组成干扰素β-1A是166个氨基酸糖蛋白,每毫克的抗病毒活性约为2亿个国际单位(IU)。它的预测分子量约为22,500 daltons,由哺乳动物(中国仓鼠卵巢)细胞产生,引入了人干扰素β基因。avonex的氨基酸序列与天然人干扰素β的氨基酸序列相同。avonex由重组DNA技术生产,并作为30微克注射溶液生产。avonex作为一种无菌溶液,用于注射干扰素β-1A,用于肌内注射。注射预填充的注射器的每种0.5 mL Avonex溶液中包含30 µg干扰素β-1A,具有600万IU的抗病毒活性。注射笔的每种0.5 mL Avonex溶液包含30 µg干扰素β-1A,具有600万IU的抗病毒活性。有关赋形剂的完整列表,请参见第6.1节。3。Pharmaceutical Form avonex预填充的注射器以单次使用注射器提供,可提供4个泡沫托盘的包装。每个水泡托盘都包含一个预填充的Avonex注射器和一个用于IM给药的针头。avonex笔提供作为单填充笔,可提供4个单独纸箱的包装。并非所有演示文稿都在新西兰分发。4。每个纸箱都包含一支avonex预填充的笔,一根16毫米,25量规针和一个avonex笔盖。临床细节4.1治疗指示AVONEX(干扰素β-1A)用于治疗多发性硬化症(MS)的复发形式。avonex在经历了单个脱髓鞘事件并且有可能基于MS的脑MRI异常的特征的患者中有可能开发临床上确定的MS的患者。
药品名称:Selpercatinib
警告: • 严重肝功能不全(Child-Pugh C)患者需要减少起始剂量并更频繁地监测 AST/ALT 2,3 • 在开始治疗前应充分控制已有的高血压 2,3 • 可能需要减少 selpercatinib 剂量以应对涉及 CYP 3A4 代谢途径的药物相互作用 2,3 • 据报道 QTc 延长;在治疗前纠正电解质异常并监测已知风险因素患者的心电图和电解质 2,3 • selpercatinib 与伤口愈合受损和出血有关;接受外科手术的患者可能需要停止使用 selpercatinib 2,3 • 肿瘤负担高、肿瘤快速生长、肾功能不全或脱水的患者可能会增加肿瘤溶解综合征的风险 2 特殊人群:如果使用 selpercatinib 治疗,生长板开放的儿科患者可能会增加生长迟缓的风险。在幼年动物研究中,观察到骨骺生长板肥大、股骨长度减少、骨矿物质密度降低和牙齿异常(例如牙齿发育不良、牙齿变色和错颌畸形)。有些影响是不可逆的。监测开放生长板患者的生长板异常。2 致癌性:尚未进行致癌性研究。2,3 致突变性:在 Ames 试验中无致突变性。Selpercatinib 在哺乳动物体内染色体试验中具有致染色体断裂作用,但在哺乳动物体外染色体试验中无致染色体断裂作用。2,3 生育力:在动物研究中,雄性受试者在暴露量低于人类临床暴露量时表现出睾丸退化、附睾腔内精子减少、剂量依赖性睾丸生殖细胞耗竭和精子细胞滞留。在暴露量约为预期人类临床暴露量的两倍时观察到精子形态的改变。当未成年雄性受试者后来在青春期与未经治疗的雌性交配时,生殖能力也会受到影响。观察到的影响包括:雄性生育力和交配指数降低、着床前和着床后损失增加、可存活胚胎减少。在雌性受试者中,发情周期数减少,可存活胚胎减少,着床后损失增加,暴露程度与人类临床暴露后相似。据报道,暴露程度低于人类临床暴露后,黄体减少或缺失,以及黄体囊肿存在。2,3 Selpercatinib 可能会损害有生育能力的男性和女性的生育能力。2 怀孕:在动物研究中,selpercatinib 具有致畸性并导致胚胎胎儿毒性。在类似或更高的暴露水平下,观察到结构畸形、早期吸收、胎儿体重下降、着床后损失增加和存活胎儿减少。比人类临床暴露后观察到的要多。2 建议在开始治疗前对有生育能力的女性患者进行妊娠测试。建议在治疗期间以及最后一次服用 selpercatinib 后至少 2 周内对有生育能力的女性患者和有生育能力的女性伴侣的男性患者进行避孕。2 由于可能分泌到乳汁中,因此不建议母乳喂养。女性在治疗期间以及最后一次服用 selpercatinib 后 2 周内不应母乳喂养。2
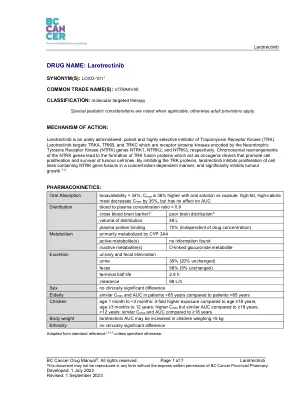
药品名称:Larotrectinib
特别注意事项:注意:•由于神经系统不良事件和疲劳常见,驾驶或操作机器的能力可能会受到影响 2,4 •已有肝功能不全的患者可能需要减少起始剂量 2,4 •与强效 CYP 3A4 抑制剂或诱导剂同时使用时可能需要调整剂量 2,4特殊人群:•与成年患者相比,儿科患者发生 3 级或 4 级中性粒细胞减少症(9-20% vs 0-2%)和体重增加(2-11% vs 0-2%)的发生率更高 2 •65 岁及以上的患者比年轻患者更容易出现疲劳、贫血、头晕、跌倒、步态不稳和低钠血症 2致癌性:未发现信息致突变性:Ames 试验和哺乳动物体外突变试验未发现致突变性。Larotrectinib 在哺乳动物体内染色体试验中不具有致染色体断裂作用。 2,4 生育力:在动物研究中,雌性受试者在暴露量比人类临床暴露量高 8 倍时,黄体减少,发情迟缓发生率增加,子宫重量下降(伴有子宫萎缩)。这些影响是可逆的。在暴露量比人类临床暴露量高 7-10 倍时,未观察到对精子发生或雄性生殖器官组织病理学的影响。2,4 妊娠:在动物研究中,拉罗替尼被证明可以穿过多个物种的胎盘,并在胎儿血液样本中检测到。拉罗替尼在母体毒性剂量以下的暴露量不具有胚胎毒性。然而,在器官形成期间给药时,在母体暴露量比人类临床暴露量高 0.6-9 倍时观察到包括脐膨出和全身水肿在内的畸形。对于有生育能力的女性,建议在开始治疗前进行妊娠测试。对于有生育能力的女性患者和有生育能力的女性伴侣的男性患者,建议在治疗期间以及最后一次服药后至少一个月内采取避孕措施。2,4 由于药物可能会分泌到乳汁中,因此不建议母乳喂养。女性在治疗期间以及最后一次服药后一周内不应进行母乳喂养。2,4
药品名称:Entrectinib
特别注意事项:警告:• 有症状的充血性心力衰竭 (CHF) 或已知有 CHF 风险因素的患者在治疗前需要进行 LVEF 评估 3 • 由于涉及 CYP 3A4 代谢途径的药物相互作用,可能需要降低恩曲替尼的起始剂量 3 • 据报道会出现 QT 间期延长;避免用于患有先天性长 QT 综合征或服用已知会延长 QT 间期药物的患者,并在治疗期间监测心电图和电解质 3,4 特殊人群:尚未确定对儿科患者的安全性和有效性。与成人 (5-6%) 相比,恩曲替尼在儿科人群中 (23%) 发生骨骼骨折(无创伤或轻微创伤)的发生率较高。在使用幼年受试者的动物研究中,在低于人类临床暴露后的暴露量下观察到体重增加减少、性成熟延迟、神经行为缺陷(例如学习和记忆)和股骨长度减少。 3,4 致癌性:未发现信息 致突变性:Ames 试验未发现致突变性;哺乳动物体内染色体试验未发现致染色体断裂性或致非整倍性。恩曲替尼在哺乳动物体外染色体试验中可能为致非整倍性。 3 生育力:在动物研究中,在高于人体临床暴露后的暴露量下观察到前列腺重量的剂量依赖性下降,但未观察到对男性和女性生殖器官的其他影响。 3 妊娠:在动物研究中,在低于和大约等于人体临床暴露后的暴露量下观察到胎儿体重降低和骨骼骨化减少。在高于人体临床暴露后的暴露量下,观察到母体毒性(体重增加和食物消耗减少)和胎儿畸形(身体闭合缺陷、脊椎、四肢和肋骨畸形)。育龄妇女在治疗期间和最后一次给药后 5 周内应采取有效的避孕措施。有育龄女性伴侣的男性应在治疗期间以及最后一次服药后 3 个月内采取有效的避孕措施。3,4 由于药物可能分泌到乳汁中,因此不建议母乳喂养。女性在治疗期间以及最后一次服药后 14 天内不应母乳喂养。3
用户的信息[产品名称] 2.5 mg/ml粉...
Bendamustine盐酸盐在开始使用此药物之前仔细阅读所有这些传单,因为它包含了重要的信息。•保留此传单。您可能需要再次阅读。•如果您还有其他问题,请询问您的医生或药剂师。•如果您有任何副作用,请与您的医生或药剂师交谈。这包括此传单中未列出的任何可能的副作用。请参阅第4节。此传单中的内容1。什么是[产品名称]以及2。使用[产品名称]3。如何使用[产品名称]4。可能的副作用5。如何存储[产品名称] 6。包装和其他信息的内容1。[产品名称]是什么,它用于[产品名称]是一种包含一种活性物质的药物,该药物称为Bendamustine盐酸盐(以下称为Bendamustine)。bendamustine是一种用于治疗某些类型癌症(细胞毒性医学)的药物。bendamustine单独使用(单疗疗法)或与其他药物的治疗以治疗以下癌症形式:•慢性淋巴细胞性白血病如果氟达拉滨组合化学疗法不适合您,•非霍奇金淋巴瘤不适合先前的疾病,或者仅适用于自动疗法,或者仅适用于自动疗法,或者是多种疾病,则•多次疗法,••多次疗法,••多重疗法,•移植,沙利度胺或含硼替佐米的疗法不适合您。2。在使用[产品名称]之前,您需要知道的是不要使用[产品名称]:•如果您对盐酸Bendamustine或该药物的其他任何成分过敏(第6节中列出)。•在母乳喂养时,如果在哺乳过程中需要用弯曲他的丁唑汀治疗,则必须停止母乳喂养(请参阅妊娠,母乳喂养和生育能力); •如果您患有严重的肝功能障碍(对肝脏功能细胞的损害)。•如果您的皮肤或白色的白色是由肝脏或血液问题引起的(黄疸)。•如果您严重干扰了骨髓功能(骨髓抑郁症),并且血液中白细胞和血小板的数量发生了严重变化•如果您在开始治疗前不到30天进行了主要的手术手术。•如果您感染,尤其是伴随着白细胞(白细胞减少)的降低的感染。
1。产品名称Losartan Actavis(氯丹钾12.5mg,25mg,50mg和100mg平板电脑)
基于生命的种族(氯沙坦干预以减少高血压的终点)研究,与atenolol相比,氯沙坦钾对心血管发病率和死亡率的益处不适用于黑人患者的高血压和左心室肥大,尽管两种治疗方案都有效地降低了黑人患者的血液压力。在整体生命研究人群中(n = 9193),与阿替诺洛尔相比,氯沙坦钾治疗的风险降低(p = 0.021),即达到心血管死亡,中风,中风和心肌梗死的患者的患者的风险降低(p = 0.021)。在这项研究中,氯沙坦钾降低了与阿替洛尔在非黑,高血压患者左心室肥大(n = 8660)中相比的心血管发病率和死亡率的风险,这是通过心血管死亡,Stroke,Stroke,STROKE和心肌施加(P = 0.0003)的主要终点所测量的。然而,在这项研究中,与接受Losartan Potassium治疗的黑人患者相比,接受阿替洛尔治疗的黑人患者患有主要复合终点的风险较低(P = 0.03)。在黑人患者的亚组中(n = 533;占生命研究患者的6%),在263例阿替诺尔(11%,每1000名患者年25.9)的患者中,有29例主要终点,在270名患者中有46例(17%,每1000名患者年41.8例)的主要终点。
CST1008 产品名称:CleanSpaceTM CST TM3A2P ...
• 配备近场通信芯片 - 通过动力装置固件收集并将过滤器使用数据传输到 CleanSpace Smart App - 过滤器和芯片未处于正确工作位置将触发动力装置中的警报。如果在此期间正在使用,CleanSpace Smart App 将显示通知 - 检测到过滤器的使用期限已过,将触发动力装置中的警报。如果在此期间正在使用,CleanSpace Smart App 将显示通知
CST1007 产品名称:CleanSpaceTM CST...
• 配备近场通信芯片 - 通过动力装置固件收集并将过滤器使用数据传输到 CleanSpace Smart App - 过滤器和芯片未处于正确工作位置将触发动力装置中的警报。如果在此期间正在使用,CleanSpace Smart App 将显示通知 - 检测到过滤器的使用期限已过,将触发动力装置中的警报。如果在此期间正在使用,CleanSpace Smart App 将显示通知
CST1006 产品名称:CleanSpaceTM CST...
• 配备近场通信芯片 - 通过动力装置固件收集并将过滤器使用数据传输到 CleanSpace Smart App - 过滤器和芯片未处于正确工作位置将触发动力装置中的警报。如果在此期间正在使用,CleanSpace Smart App 将显示通知 - 检测到过滤器的使用期限已过,将触发动力装置中的警报。如果在此期间正在使用,CleanSpace Smart App 将显示通知
UN38.3 Test Report 样品名称: 摄像机锂电池组
Test cells shall be secured to the testing machine by means of a rigid mount which will support all mounting surfaces of each test cell.Each cell or battery shall be subjected to a half-sine shock of peak acceleration of 150 gn and pulse duration of 6 milliseconds.Alternatively, large cells may be subjected to a half-sine shock of peak acceleration of 50 gn and pulse duration of 11 milliseconds.Each cell shall be subjected to three shocks in the positive direction followed by three shocks in the negative direction of three mutually perpendicular mounting positions of the cell or battery for a total of 18 shocks./ 以稳固的托架固定住每个样品。对每个电芯 样品以峰值为 150gn 的半正弦的加速度撞击,脉冲持 续 6ms ,另外,大电芯须经受最大加速度 50gn 和脉 冲持续时间 11ms 的半正弦波冲击,每个样品必须在 三个互相垂直的电池安装方位的正方向经受三次冲 击,接着在反方向经受三次冲击,总共经受 18 次冲 击。




![用户的信息[产品名称] 2.5 mg/ml粉...](/simg/7/775a7a8eb488589d932d3771514a1f63ea486a13.webp)




