XiaoMi-AI文件搜索系统
World File Search SystemMIDAP 处方集
阿扎那韦 (REYATAZ)* 阿扎那韦/考比司他 (EVOTAZ) 比克替拉韦/恩曲他滨/替诺福韦 (BIKTARVY) 卡博特韦/利匹韦林 (CABENUVA/VOCABRIA) PA 考比司他 (TYBOST) 达芦那韦 (PREZISTA) ST2 达芦那韦/考比司他 (PREZCOBIX) 达芦那韦/考比司他/替诺福韦/恩曲他滨 (SYMTUZA) 地拉韦定 (RESCRIPTOR) 地达诺辛 (VIDEX EC*, VIDEX soln) 多替拉韦/利匹韦林 (JULUCA) 多替拉韦/拉米夫定 (DOVATO) 多拉韦林 (PIFELTRO) 多拉韦林/拉米夫定/替诺福韦 (DELSTRIGO) 依法韦仑 (SUSTIVA) 依法韦仑/恩曲他滨/替诺福韦(ATRIPLA)* Efavirenz/lamivudine/tenofovir (SYMFI, SYMFI LO) Elvitegravir/Cobicistat/Emtricitabine/Tenofovir (STRIBILD, GENVOYA) ST1 Emtricitabine (EMTRIVA, EMTRIVA soln*) Emtricitabine/tenofovir (TRUVADA, DESCOVY) Emtricitabine/rilpivirine/tenofovir (COMPLERA) Enfuvirtide (FUZEON), QL Etravirine (INTELENCE) Fosamprenavir (LEXIVA) Fostemsavir (RUKOBIA) Ibalizumab (TROGARZO) PA Indinavir (CRIXIVAN) Lamivudine (EPIVIR)* Lamivudine/tenofovir (CIMDUO) Lamivudine/zidovudine (COMBIVIR)* Lencapavir (SUNLENCA) PA Lopinavir/Ritonavir (KALETRA) 马拉维若 (SELZENTRY) 奈非那韦 (VIRACEPT) 奈韦拉平 (VIRAMUNE)* 雷替拉韦 (ISENTRESS) 利匹韦林 (EDURANT) 利匹韦林/恩曲他滨/替诺福韦 (ODEFSEY) 利托那韦 (NORVIR) ST1 沙奎那韦 (INVIRASE) ST2 司他夫定 (ZERIT)* 替诺福韦 (VIREAD、VEMLIDY)* 替拉那韦 (APTIVUS)、ST2 齐多夫定 (RETROVIR)*
sglt2i处方工具
¶SGLT2I疗法应在需要胰岛素剂量迅速减少的人中谨慎开处方,这可能会增加DKA风险。2-5 *决策应基于最近的EGFR测量,而不是历史测试。‡empagliflozin,dapagliflozin和erertugliflozin疗法只能在EGFR60ml/min/min/1.73m 2的人中启动,并且可能继续在需要更紧密的Glycepic控制的人处方,直到EGFR到达EGFR到达45 mL/min/min/min/1.733m 2。3-5¥患者患有蛋白尿(尿白蛋白:肌酐比率> 30 mg/mmol)和EGFR≥30mL/min/min/1.73m 2的人现在可以在Canagliflozin 100mg上启动,并且还可以在治疗时保持在治疗中,直到透析或肾脏移植。2 **信任研究和参加已发表的SGLT2I CV结果试验的一些子人群包括接受循环利尿剂的人。9-12然而,Canagliflozin当前未获得与Loop利尿剂和其他SGLT2的使用许可,建议对量耗尽的迹象进行持续监控。2-5监控HBA1C水平定期,如果升高的水平持续,则停止SGLT2IS。⚫dapagliflozin(5 mg)是唯一获得1型糖尿病(胰岛素辅助;由专家开始和监督的SGLT2I)。†SGLT2I治疗应暂停在急性疾病的个体中,直到完全康复为止。2-5,13,14由于葡萄糖症引起的尿症状可能是处方SGLT2I药物的人的问题。2-5但是,UTI相对罕见,这些药物可能会针对有尿路病史的人开处方。
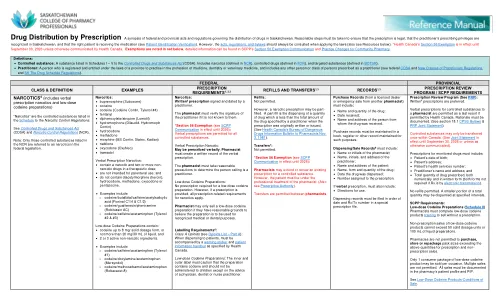
按处方分配药物
麻醉剂:由执业医师签名并注明日期的书面处方。如果药剂师不知道执业医师的签名,则必须核实。 *第 56 条豁免(参见 SCPP 通讯,有效期至 2026 年):所有管制物质都允许口头开处方。口头处方麻醉剂:可以口头开处方。药剂师必须创建口头处方的书面记录。药剂师必须采取合理的预防措施确定打电话的人是否是执业医师。低剂量可待因制剂:低剂量可待因制剂不需要处方。但是,如果提供了处方,则适用所有与麻醉剂处方相关的要求。药剂师只有在有合理理由相信低剂量可待因制剂将用于公认的医疗或牙科目的时才可以销售该制剂。标签要求 6:A 类阿片类药物(参见阿片类药物清单 - A 部分):在分发给患者时,必须附上加拿大卫生部规定的警告标签和患者信息手册。低剂量可待因制剂:内标签和外标签必须警告,该制剂含有可待因,除非在医生、牙医或执业护士的建议下,否则不得给儿童服用。
处方信息重点这些...
与酒精相互作用 ADDYI 和酒精在时间接近时一起使用增加严重低血压和晕厥的风险[见警告和注意事项(5.1)]。忠告患者在睡前服用 ADDYI 前至少等待两小时消耗一或两标准酒精饮料后或如果他们当晚已消耗三或更多标准酒精饮料则跳过他们的 ADDYI 剂量。 与强或中度 CYP3A4 抑制剂禁忌 ADDYI 和中度或强度 CYP3A4 抑制剂的同时使用增加氟班色林浓度,这可致严重低血压和晕厥[见警告和注意事项(5.2)]。所以,服用 ADDYI 的患者禁忌使用中度或强度 CYP3A4 抑制剂[见禁忌症(4)]。肝功能不全患者禁用 在肝功能不全患者中使用ADDYI会增加氟班色林浓度,这可能导致严重低血压和晕厥[见警告和注意事项(5.5)]。因此,肝功能不全患者禁用ADDYI[见禁忌症(4)]。
处方平台疫苗
与自源疫苗不同,RXPP疫苗可以用于参加兽医决定的任何动物中,可以从其使用中受益。RXPP疫苗在商业上可用(货架上)疫苗不是可行的选择的情况下,也可以满足需求。商业疫苗可能需要数年的时间才能开发,并且在需要新的新兴疾病时可能无法使用。此外,多年来可用的商业疫苗可能包含过时的抗原,这些抗原并不反映当前引起该领域问题的菌株。RXPP疫苗可以使用这些新菌株的Gois来开发当前的疫苗,而无需漫长的等待时间。在许多情况下,可以在不到十二周的时间内完成RXPP疫苗的生产。RXPP产品的另一个独特优势是,它们可用于许多新兴疾病,在没有其他方法可以创建疫苗的情况下。许多引起新兴疾病的药物不能在体外生长,因此不能使用传统的自动疫苗,并且无法开发商业疫苗。但是,可以通过分子测序来检测这些药物,可以从中得出并插入GOIS并插入RXPP主链中,从而使疫苗的生产以对抗疾病。
处方信息的重点这些...
开处方信息的重点这些重点并不包括安全有效地使用Xcopri所需的所有信息。请参阅XCOPRI的完整处方信息。XCOPRI ® (cenobamate tablets), for oral use, CV Initial U.S. Approval: 2020 _________________ RECENT MAJOR CHANGES _________________ Dosage and Administration, Administration Instructions (2.3) 4/2024 __________________ INDICATIONS AND USAGE _________________ XCOPRI is indicated for the treatment of partial-onset seizures in adult patients.(1)_______________剂量和给药______________•建议的XCOPRI初始剂量每天一次为12.5 mg,滴定为建议的维护剂量为200 mg每天一次。不应超过建议的滴定时间表。最高剂量为每天400毫克。(2.1)•肝损伤:对于轻度或中度肝损伤的患者,建议的最高剂量为200 mg每天一次。(2.2,8.7,12.3)•可以全部服用Xcopri,也可以将片剂压碎。碎片可以与水混合,然后通过口腔施用作为口服悬浮液或通过鼻腔管施用。(2.3)
处方药物指南
处方可以以书面形式写在处方笺、顾客记录上,也可以通过电子病历或电子提交以电子方式授权。电子处方是指在授权开具处方的人员和顾客选择的药房之间以安全电子的方式创建和传输处方。电子药单只能通过符合法律、CRNS 和雇主要求的安全网络发送。电子处方要求授权开具处方的人员在电子病历 (EMR) 或其他独立应用程序中创建处方。电子处方满足《药品信息计划》(PIP) 中定义的所有电子处方要求。一旦处方在系统内以数据形式安全地传输,药剂师就可以查看它。通常,处方不会自动填写,而是需要顾客采取行动来请求准备和配发处方。萨斯喀彻温省的所有药房都配备了接受电子处方或处方笺上的书面处方的设备。
处方信息重点
在一项针对成人的安慰剂对照试验(研究 1;基于 120 周的访问窗口)中,SIRTURO 治疗组(9/79,11.4%)的死亡风险高于安慰剂治疗组(2/81,2.5%)。在 SIRTURO 给药的 24 周内,有 1 例患者死亡。死亡人数的不平衡无法解释。未观察到死亡与痰培养转变、复发、对治疗结核病的其他药物的敏感性、HIV 状态或疾病严重程度之间的明显模式。在随后的成人阳性对照试验(研究 4)中,到第 132 周时,40 周 SIRTURO 治疗组有 11/211(5.2%)名患者死亡,阳性对照治疗组有 8/202(4%)名患者死亡,其中包括 29 名接受 SIRTURO 作为挽救治疗一部分的患者中的 4 名,28 周 SIRTURO 治疗组有 2/143(1.4%)名患者死亡[见不良反应(6.1)]。
处方信息的亮点
警告:胚胎毒性1 1.1用法1.1肺动脉高压2剂量和给药2.1推荐剂量2.2剂量2.2孕妇在女性的妊娠试验3剂量和强度3剂量和优势的女性中,4.1偶然性4.1妊娠4.1妊娠4.2高度4.3浓度4.3浓度固定有机体4.4固定有机剂有机体(4.4) 5 WARNINGS AND PRECAUTIONS 5.1 Embryo-fetal Toxicity 5.2 Macitentan-Containing Products REMS 5.3 Hepatotoxicity 5.4 Hypotension 5.5 Hemoglobin Decrease 5.6 Worsening Pulmonary Veno-Occlusive Disease (PVOD) 5.7 Visual Loss 5.8 Hearing Impairment 5.9 Fluid Retention 5.10 Combination with Other PDE5 Inhibitors 5.11 Decreased Sperm Count 5.12 Prolonged勃起6不良反应6.1临床试验经验6.2后市场后经验