XiaoMi-AI文件搜索系统
World File Search System海报Actrims 2024 NFL Final
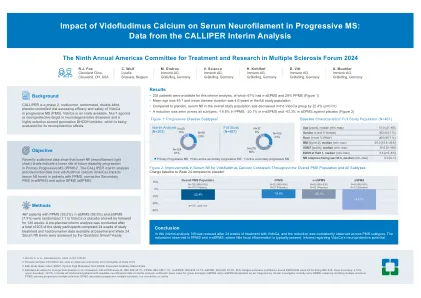
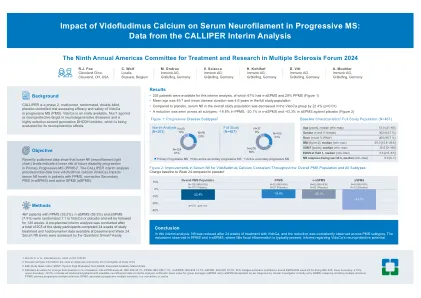
上边界-12.0%,包括所有在临时分析中具有可用神经丝数据的随机患者,组平均值的算术平均值;根据临床研究者的诊断,ASPM和N-ASPMS名称在研究条目RRMS:复发复发多发性硬化症; PPM:主要进行性多发性硬化症; SPM:继发性多发性硬化症; N-A:非活动;答:活动
Medtronic报告全年和第四季度2024财年...
上边界-12.0%,包括所有在临时分析中具有可用神经丝数据的随机患者,组平均值的算术平均值;根据临床研究者的诊断,ASPM和N-ASPMS名称在研究条目RRMS:复发复发多发性硬化症; PPM:主要进行性多发性硬化症; SPM:继发性多发性硬化症; N-A:非活动;答:活动
一本关于 MS 的儿童活动书
如果您刚刚发现您的妈妈或爸爸或您认识的其他人患有多发性硬化症 (MS),或者即使他们已经患病一段时间,您可能也会有很多疑问。您并不孤单!很多孩子对 MS 有疑问。多发性硬化症很难说和拼写,而且很难完全理解!这本活动书适合您。它将帮助您回答一些问题。它还可以帮助您与家人和朋友谈论多发性硬化症可能带来的变化。
Emory精神病学和行为科学系荣誉BMI谈话 - 4月16日-Yaomin Xu
摘要:多种健康状况在个人中共存非随意的,这对医疗保健和社会来说是日益严重的挑战。理解多发性模式可以导致更好的预防,治疗和个性化护理。电子健康记录的出现(EHR)系统提供了大量数据,用于研究现实世界的患者健康动态。然而,对EHR的主要设计用于计费和管理的关注提出了有关基于EHR的研究的一致性和可重复性的问题。在这项研究中,我们使用了国际疾病(ICD)代码分类来分析疾病合并症模式并采用了网络建模,以检查两个主要EHR系统的多发性。我们的发现揭示了她的系统之间高度相关的多发性模式,并通过图理论分析证实了本地(节点和边缘),全局(网络统计)和MESO(相邻连接结构)量表的多发性网络的一致性。此结果为开发有效的框架提供了新的见解,以分析和比较多种多发性网络中的复杂结构。我们的案例研究表明,识别多发性网络中的子图是检测疾病状况群集的有效方法,在多个多发性网络的图谱特征的支持下,我们开发了一种完整的在线网络聚类聚类算法作为识别这些簇的有效方法。为了促进访问这些复杂的数据集并促进进一步的发现研究和假设生成,我们开发了一套交互式可视化工具,用于复杂的在线数据分析利用来自多个EHR/Biobank数据源的数据。这些工具是开源的,可供公众使用,旨在使研究人员能够直观地探索多种多发性网络中的复杂疾病关系,从而增强了我们的集体理解并促进了在多重警察的背景下开发新颖的精确药物解决方案。
瘫痪参考书目的临床实践指南...
临床实践指南:成年女性的尿导管插入术。Pittman,新泽西州:泌尿外科护士和同事协会,2021。https://www.suna.org/resources/clinical-practice单击尿液导管护理,请参阅临床实践程序,请参阅临床实践程序并选择相关标题。 临床实践指南:成年男性的尿导管插入。 Pittman,新泽西州:泌尿外科护士和同事协会,2021。https://www.suna.org/resources/clinical-practice单击尿液导管护理,请参阅临床实践程序,请参阅临床实践程序并选择相关标题。 尿功能障碍和多发性硬化症:多发性硬化症 /多发性硬化症临床实践指南中尿功能障碍的基于证据的管理策略。 华盛顿特区:美国瘫痪的退伍军人,1999年。https://www.nationalmssociety.org/nationalmsssociety/media/mmedia/msnationalfiles/brochure s/brochure-brochure-urinary-urinary-urinary-urinary-urinary-rinary-dysfunction-and-dysfunction-and-ms.pdf /div>/div>/div>Pittman,新泽西州:泌尿外科护士和同事协会,2021。https://www.suna.org/resources/clinical-practice单击尿液导管护理,请参阅临床实践程序,请参阅临床实践程序并选择相关标题。临床实践指南:成年男性的尿导管插入。Pittman,新泽西州:泌尿外科护士和同事协会,2021。https://www.suna.org/resources/clinical-practice单击尿液导管护理,请参阅临床实践程序,请参阅临床实践程序并选择相关标题。 尿功能障碍和多发性硬化症:多发性硬化症 /多发性硬化症临床实践指南中尿功能障碍的基于证据的管理策略。 华盛顿特区:美国瘫痪的退伍军人,1999年。https://www.nationalmssociety.org/nationalmsssociety/media/mmedia/msnationalfiles/brochure s/brochure-brochure-urinary-urinary-urinary-urinary-urinary-rinary-dysfunction-and-dysfunction-and-ms.pdf /div>/div>/div>Pittman,新泽西州:泌尿外科护士和同事协会,2021。https://www.suna.org/resources/clinical-practice单击尿液导管护理,请参阅临床实践程序,请参阅临床实践程序并选择相关标题。尿功能障碍和多发性硬化症:多发性硬化症 /多发性硬化症临床实践指南中尿功能障碍的基于证据的管理策略。华盛顿特区:美国瘫痪的退伍军人,1999年。https://www.nationalmssociety.org/nationalmsssociety/media/mmedia/msnationalfiles/brochure s/brochure-brochure-urinary-urinary-urinary-urinary-urinary-rinary-dysfunction-and-dysfunction-and-ms.pdf /div>/div>/div>
使用扩散模型增强多模态 MRI 扫描中的多发性硬化症病变分割
摘要 — 从磁共振成像 (MRI) 扫描中准确分割多发性硬化症 (MS) 病变对于临床诊断和有效治疗计划至关重要。在这项工作中,我们研究了扩散模型 (DM) 在实现 MS 病变像素分割方面的有效性。DM 显著提高了分割灵敏度,尤其是在具有细微异常的区域。我们使用来自公共数据集的磁共振体积进行了广泛的实验,涵盖了各种成像模式。我们的分析证明了 DM 如何实现与最先进技术相当的性能水平,平均 Dice 系数与现有最佳方法相当就是明证。此外,标准 DM 的一些变体在各种成像模式下都表现出稳健性,展示了其在临床环境中的多功能性。索引词 — 多发性硬化症、去噪扩散模型、病变分割、医学图像分析
多发性硬化症上肢康复机器人系统:SWOT 分析以及与虚拟和增强环境的协同作用
机器人学科正在探索用于多发性硬化症 (MS) 上肢康复的精确而通用的解决方案。多发性硬化症患者可以从机器人系统中受益匪浅,这有助于对抗这种疾病的复杂性,这种疾病可能会损害他们执行日常生活活动 (ADL) 的能力。为了展示智能机电设备在上述临床领域的潜力和局限性,本综述旨在提出一个简明的 SWOT(优势、劣势、机会和威胁)分析,以分析多发性硬化症中的机器人康复。通过 SWOT 分析(一种主要在企业管理中采用的方法),本文探讨了可能促进或阻碍多发性硬化症上肢康复机器人采用的内部和外部因素。随后,本文讨论了与另一类交互技术(虚拟和增强环境的基础系统)的协同作用如何增强优势、克服劣势、扩大机会并处理多发性硬化症康复机器人中的威胁。这些数字化环境的强大适应性(广泛用于 MS 康复,甚至可以在安全的模拟环境中完成类似 ADL 的任务)是提出这种方法以应对上述 SWOT 分析的关键问题的主要原因。该方法论提案旨在为制定进一步的协同战略铺平道路,这些战略基于医疗机器人设备与其他有前景的技术的整合,以帮助 MS 的上肢功能恢复。
使用深度学习自动分割多发性硬化症病变的脑叶并提取特征
摘要:本研究重点是自动分割多发性硬化症 (MS) 病变 MRI 图像中的脑叶,以提取预测残疾程度的关键特征。由于病变特征的多变性和 MRI 图像的细节性质,从 MS 病变的 MRI 图像中提取重要特征确实是一项复杂的任务。此外,所有这些研究都需要持续的患者监测。因此,我们的贡献在于提出一种自动分割脑叶和提取病变特征(数量、大小、位置等)以预测 MS 患者残疾程度的方法。为了实现这一目标,我们引入了一个受 U-Net 启发的模型来对不同的脑叶进行分割,旨在准确定位 MS 病变。我们使用了两个私人和公共数据库,平均 IoU 得分为 0.70,这可以说是令人鼓舞的。在分割阶段之后,从 MS 患者的 MRI 扫描中提取了大约 7200 个特征。