XiaoMi-AI文件搜索系统
World File Search Systemcap-004-icar-poster-final.pdf
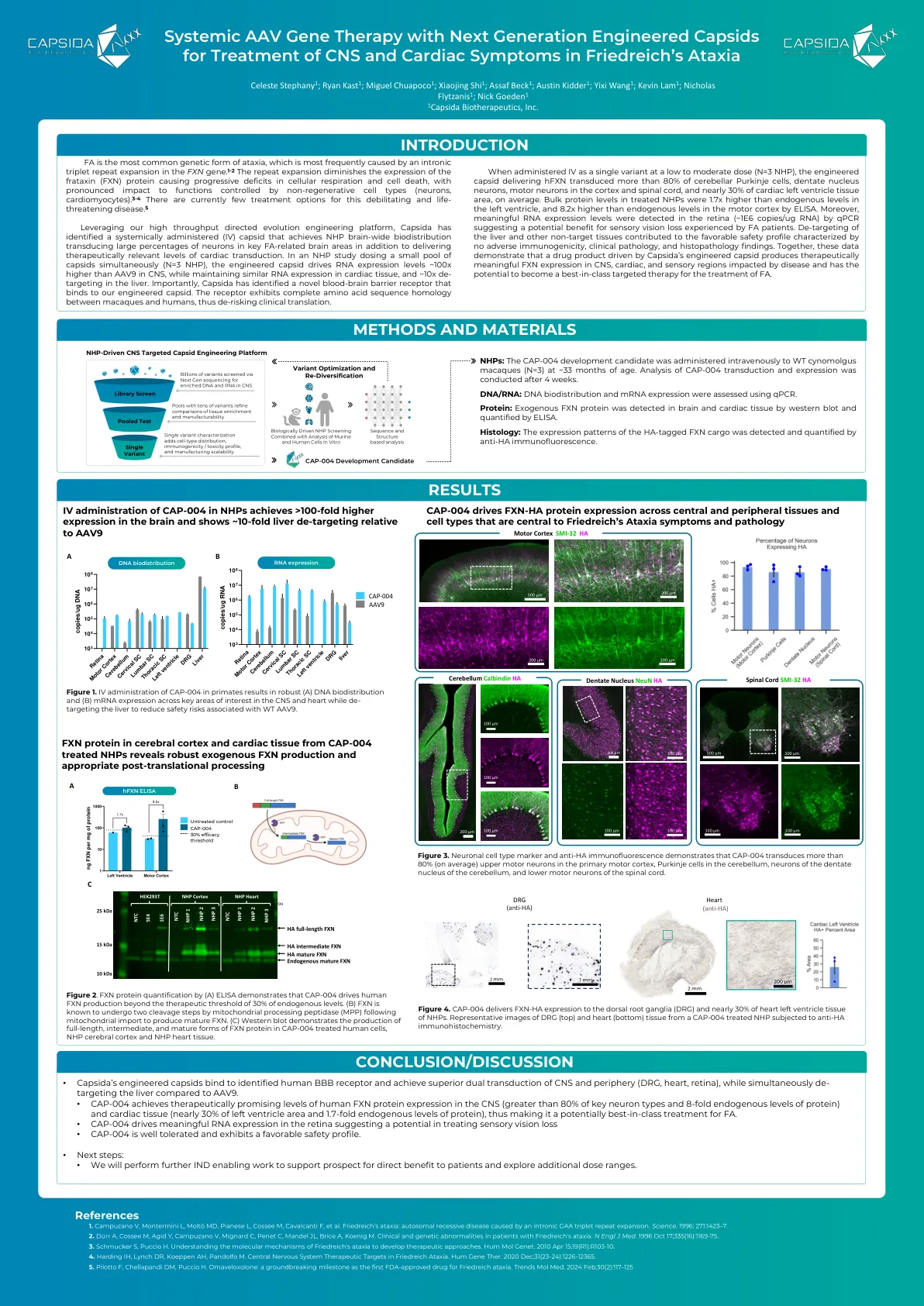
利用我们高通量的定向进化工程平台,Capsida确定了一个系统地给药的(IV)Capsid,该capsID可实现NHP脑范围的生物分布,除了提供治疗相关的心脏转移水平外,还可以在关键FA相关的大脑区域中转导大量的神经元。在NHP研究中,同时给予一小片capsID(n = 3 NHP),工程化的衣壳驱动的RNA表达水平比CNS中的AAV9高约100倍,同时在心脏组织中保持相似的RNA表达,并且在肝脏中降低了约10x。重要的是,Capsida已经确定了一种与我们工程化的衣壳结合的新型血脑屏障受体。受体在猕猴和人类之间表现出完整的氨基酸序列同源性,从而使临床翻译变得过时。
宫颈癌的 T 细胞免疫疗法 - 前沿
肿瘤细胞免疫治疗在临床实践中取得了鼓舞人心的治疗效果,为宫颈癌的治愈带来了新的希望。CD8+T细胞是抗肿瘤免疫中对癌症有效的细胞毒效应细胞,而以T细胞为基础的免疫治疗在细胞免疫治疗中起着至关重要的作用。肿瘤滤过淋巴细胞(TIL)作为天然的T细胞,被批准用于宫颈癌的免疫治疗,而工程化T细胞治疗也取得了令人瞩目的进展。带有天然或工程化肿瘤抗原结合位点的T细胞(CAR-T、TCR-T)在体外扩增,回输给患者以消灭肿瘤细胞。本文总结了以T细胞为基础的宫颈癌免疫治疗的临床前研究和临床应用,以及宫颈癌免疫治疗面临的挑战。
宫颈癌的T细胞免疫治疗
肿瘤细胞免疫治疗在临床实践中取得了鼓舞人心的治疗效果,为宫颈癌的治愈带来了新的希望。CD8+T细胞是抗肿瘤免疫中对癌症有效的细胞毒效应细胞,而以T细胞为基础的免疫治疗在细胞免疫治疗中起着至关重要的作用。肿瘤滤过淋巴细胞(TIL)作为天然的T细胞,被批准用于宫颈癌的免疫治疗,而工程化T细胞治疗也取得了令人瞩目的进展。带有天然或工程化肿瘤抗原结合位点的T细胞(CAR-T、TCR-T)在体外扩增,回输给患者以消灭肿瘤细胞。本文总结了以T细胞为基础的宫颈癌免疫治疗的临床前研究和临床应用,以及宫颈癌免疫治疗面临的挑战。
利用工程化的超级色酮对抗抗生素耐药性金黄色葡萄球菌,彻底改变中毒性休克综合征的治疗方法
摘要。– 目的:金黄色葡萄球菌引起的中毒性休克综合征 (TSS) 是一种罕见但可能致命的疾病,治疗选择有限。抗生素耐药菌株的出现迫切需要开发有效的治疗方法。本研究旨在通过使用色酮作为先导化合物靶向致病毒素蛋白来识别和优化针对中毒性休克综合征的潜在候选药物。材料和方法:在本研究中,筛选了 20 种色酮以确定它们与目标蛋白的结合能力。通过添加环庚烷和酰胺基团进一步优化最佳化合物,并使用化学吸收、分布、代谢、排泄和毒性 (ADMET) 分析评估所得化合物的类药特性。结果:在筛选的化合物中,7-葡萄糖氧基-5-羟基-2-[2-(4-羟基苯基)乙基]色酮表现出最高的结合亲和力,分子量为341.40 g/mol,结合能为-10.0 kcal/mol。优化后的化合物表现出良好的类药物特性,包括高水溶性、合成可及性、皮肤渗透性、生物利用度和胃肠道吸收。结论:这项研究表明,色酮可以进行工程改造,以开发有效的药物来对抗金黄色葡萄球菌引起的中毒性休克综合征。优化后的化合物有可能成为治疗中毒性休克综合征的一种有前途的治疗剂,为患有这种危及生命的中毒性休克综合征的患者带来新的希望。
arXiv:2209.06317v3 [cs.AI] 2024 年 12 月 4 日
∗ 这是即将在《西顿霍尔立法与公共政策杂志》上发表的文章草稿。1 我们将人工智能系统定义为“一种工程化或基于机器的系统,它可以针对给定的一组目标生成输出,例如影响现实或虚拟环境的预测、建议或决策 [ 1 ]。”
腺相关病毒工具包可靶向多种脑细胞
重组腺相关病毒 (AAV) 是神经科学研究中常用的基因传递载体。它们具有两个可工程化的特征:衣壳(外部蛋白质壳)和货物(封装的基因组)。可以修改这些特征以分别增强细胞类型或组织向性并控制转基因表达。已经鉴定出几种具有独特向性的工程化 AAV 衣壳,包括具有增强的中枢神经系统转导、细胞类型特异性和神经元逆向运输的变体。将这些 AAV 与现代基因调控元件和最先进的报告、传感器和效应货物配对,可以实现高度特异性的转基因表达,以对脑细胞和回路进行解剖和功能分析。在这里,我们讨论了最近的进展,这些进展提供了一个全面的(衣壳和货物)AAV 工具包,用于遗传访问分子定义的脑细胞类型。
通过 CRISPR 进行高效、安全的基因组编辑...
摘要 CRISPR-Cas12a 系统已被开发用于在真核细胞中实现高度特异性的基因组编辑。鉴于 Cas12a 基因相对较小,该系统被认为最适用于使用 AAV 载体递送的基因治疗。之前,我们报道了富含 U 的 crRNA 能够通过 CRISPR-Cas12a 系统在真核细胞中进行高效的基因组编辑。在本研究中,我们在 crRNA 富含 U 的 3 ′-突出端的核糖 C2 处引入了甲氧基修饰。当与 Cas12a 效应蛋白混合时,核糖基-2 ′-O-甲基化 (2-OM) 富含 U 的 crRNA 能够提高 dsDNA 的消化率。此外,化学修饰的富含 U 的 crRNA 在小鼠受精卵中实现了非常安全且高度特异性的基因组编辑。工程化的 CRISPR-Cas12a 系统有望促进各种动物模型的生成。此外,工程化的 crRNA 也得到了评估,以进一步改进 CRISPR 基因组编辑工具集。
利用 CasPlus 和优化的向导 RNA 预防工程化人类原代 T 细胞中的大量缺失和染色体丢失
。CC-BY-NC-ND 4.0 国际许可证(未经同行评审认证)是作者/资助者,他已授予 bioRxiv 永久展示预印本的许可。
最初发表于:Jetzer, Tania;Studer, Luka;Bieri, Manuela;Greber, Urs;Hemmi, Silvio (2023)。B 类人工腺病毒
最初发表于:Jetzer, Tania;Studer, Luka;Bieri, Manuela;Greber, Urs;Hemmi, Silvio (2023)。B 和 C 类工程化人类腺病毒报告了早期、中早期和晚期病毒基因表达。《人类基因治疗》,34(23- 24):1230-1247。DOI:https://doi.org/10.1089/hum.2023.121
一种工程化的抗独特型抗体衍生的杀伤肽(KP)早期激活猪炎症单核细胞、CD3+CD16+自然杀伤T细胞和C
本研究评估了用基于抗独特型抗体(功能上模拟酵母杀伤毒素)的工程杀伤肽 (KP) 处理的猪免疫细胞的表型和细胞因子分泌的早期调节。使用猪生殖与呼吸综合征病毒 (PRRSV) 和猪圆环病毒 2 型 (PCV2) 作为体外抗原研究了 KP 对特异性免疫的影响。用 KP 和杂乱肽刺激健康猪的外周血单核细胞 (PBMC) 20 分钟、1、4 和 20 小时或保持不刺激。使用流式细胞术和 ELISA 分析细胞。使用相同的时间段进行 KP 预孵育/共孵育,以使用 ELISPOT 确定对病毒回忆干扰素-γ (IFN- γ ) 分泌细胞 (SC) 频率和单细胞 IFN- γ 生产力的影响。KP 诱导早期剂量依赖性转变至促炎性 CD172 α + CD14 +high 单核细胞和增加 CD3 + CD16 + 自然杀伤 (NK) T 细胞。KP 触发经典 CD4 − CD8 αβ + 细胞毒性 T 淋巴细胞 (CTL) 和双阳性 (DP) CD4 + CD8 α + Th 记忆细胞 (CD4 + CD8 α +low CD8 β +low) 上的 CD8 α 和 CD8 β 表达。一部分 DP 细胞也表达高水平的 CD8 α 。已鉴定的两种 DP CD4 + CD8 α +高 CD8 β +低/+高 CTL 亚群与肿瘤坏死因子 α (TNF- α ) 和 IFN- γ 分泌有关。KP 显著增强了 PRRSV 1 型和 PCV2b 特异性 IFN- γ SC 的反应性和交叉反应性。结果表明 KP 在刺激 Th1 偏向免疫调节方面有效,并支持将 KP 作为免疫调节剂或疫苗佐剂进行研究。




![arXiv:2209.06317v3 [cs.AI] 2024 年 12 月 4 日](/simg/6\638e631b8ee0b06487fb0006a9b4e6735f567db1.png)




