XiaoMi-AI文件搜索系统
World File Search System基因组编辑的同种异体供体“
自体基因 - 经过修饰的T细胞,包括嵌合抗原受体(CAR)T细胞,已通过临床试验广泛研究了T细胞,从而从美国食品药物管理局获得了针对血液恶性肿瘤的新基于细胞的疗法的批准。抗CD19 CAR T细胞疗法Tisagenle-Cleucel被批准用于难治性或复发(R/R)B细胞急性淋巴细胞性白血病(B-ALL)和非霍奇金淋巴瘤淋巴瘤(NHL)1 - 4和ADICADAGEBTAGEN CILOLELOLEUCELELICAL b-CLELL-limpl follicular follicular follicular follicular follicular follicular follicular follicular follicular follicular follicular follical and and。5 - 7 Brexucabtagene Autoleucel已被授权用于B-All和Gulantle细胞淋巴瘤,8、9和Liso-Cabtagene Maraleucel用于B-cell NHL。10对于多发性骨髓瘤,idecabtagene速糖和Ciltacabtagene Autoleucelare可用于R/R多发性骨髓瘤。11 - 14在商业开发或学术中心提供的各种额外的自动疗法。15、16
同种异体手移植或自体手再植后初级躯体感觉皮质的变化
接受同种异体手移植或自体手再植(统称“手部修复”)的截肢者提供了一个独特的机会来测量失神经系统后可塑性变化的范围,特别是初级躯体感觉皮层(S1)。然而,这样的病人很少,之前的研究将个案与小群典型成年人进行了比较。在这里,我们研究了 5 个个体(n = 8 个疗程:一个移植手术进行了 2 个疗程,一个移植手术进行了 3 个疗程,三次再植手术各进行了 1 个疗程)。我们使用功能性磁共振成像(fMRI)来测量 S1 对传递到每个病人左右指尖和下脸部的受控气动触觉刺激的反应。这些数据与从典型成年人(n = 29)和当前单侧截肢者(n = 19)获得的反应进行了比较。在刺激患手期间,患者患侧 S1(患手的对侧)对刺激的反应方式与截肢者和典型成年人相似。对侧反应的存在表明 S1 功能大致典型,但反应普遍处于典型变异范围的低端。患者患侧 S1 对完整手部刺激的反应表现出很大的个体差异:虽然所有患者都属于典型成年人的范围,但一些患者(4/8)的同侧反应与当前截肢者表现出的类似。与手部修复患者不同,当前截肢者与典型成年人相比表现出明显的 S1 重组,包括对完整手部刺激的双侧 S1 反应。在所有三个参与者组中,我们通过测量个体识别手掌和手指触摸位置的能力来评估触觉定位。奇怪的是,虽然移植患者的触觉定位能力随着时间的推移有所改善,但这与 S1 对触觉刺激的反应变化无关。总体而言,我们的研究结果首次描述了手部修复后皮质对良好控制的触觉刺激的反应。我们的案例研究表明,手
复发中的同种异体BCMA靶向CAR T细胞/ ... div>
Allo-715是一种一类同种异体,抗BCMA CAR T细胞疗法,该疗法设计为消除移植物抗宿主疾病并最大程度地减少汽车的排斥。,我们评估了43例正在进行的首次 - 人类第1阶段1通用试验的一部分的43例复发/难治性多发性骨髓瘤作为一部分的43例抗C-CD52抗体(Allo-647)抗体(Allo-647)持续剂量的Allo-715。主要目标包括确定Allo-715的安全性和耐受性以及含有Allo-647的淋巴结治疗方案的安全性。关键的次要终点是响应率和响应持续时间。≥3级不良事件报告了38例(88.0%)的患者。细胞因子释放综合征,其中1级≥3级(2.3%)和6例患者的神经毒性(14%),没有≥3级。感染发生在23例患者(53.5%)中,其中10级(23.3%)≥3。总体而言,有24名患者(55.8%)有反应。在用320×10 6 CAR + T细胞治疗的患者中以及基于氟达拉滨,环磷酰胺和Allo-647基于Allo-647的淋巴结治疗方案(n = 24),17(70.8%)的反应,包括11(45.8%),包括很好的部分响应或完全响应,以及完整的响应响应,并具有完整的响应。响应的中间持续时间为8.3个月。这些最初的结果支持同种异体CAR T细胞治疗对骨髓瘤的可行性和安全性。
CAR-T和同种异体干细胞移植在淋巴肿瘤治疗中都有用吗?
摘要:异基因干细胞移植 (allo-SCT) 是治疗血液系统恶性肿瘤的首个免疫疗法:它一直被认为是一种疾病的治疗方法,但从未被认为是一种延长患者生命的方法。异基因干细胞移植的成功既源于它能够用强化放化疗治疗患者,也源于供体免疫介导的强大移植物抗白血病效应。尽管近年来取得了长足的进步,但疾病复发、移植物抗宿主病、感染并发症和治疗方案相关毒性等重大障碍仍然存在。此外,随着基因改造自体 T 淋巴细胞疗法 (CAR-T) 的商业化引入,血液系统恶性肿瘤(尤其是急性淋巴细胞白血病和某些形式的淋巴瘤)的治疗发生了革命性的变化。我们的回顾讨论了异基因干细胞移植适应症的现行标准和不断变化的范式以及 CAR-T 细胞治疗对淋巴肿瘤的作用。
p-muc1c-allo1 同种异体 car-t 细胞的 1 期研究...
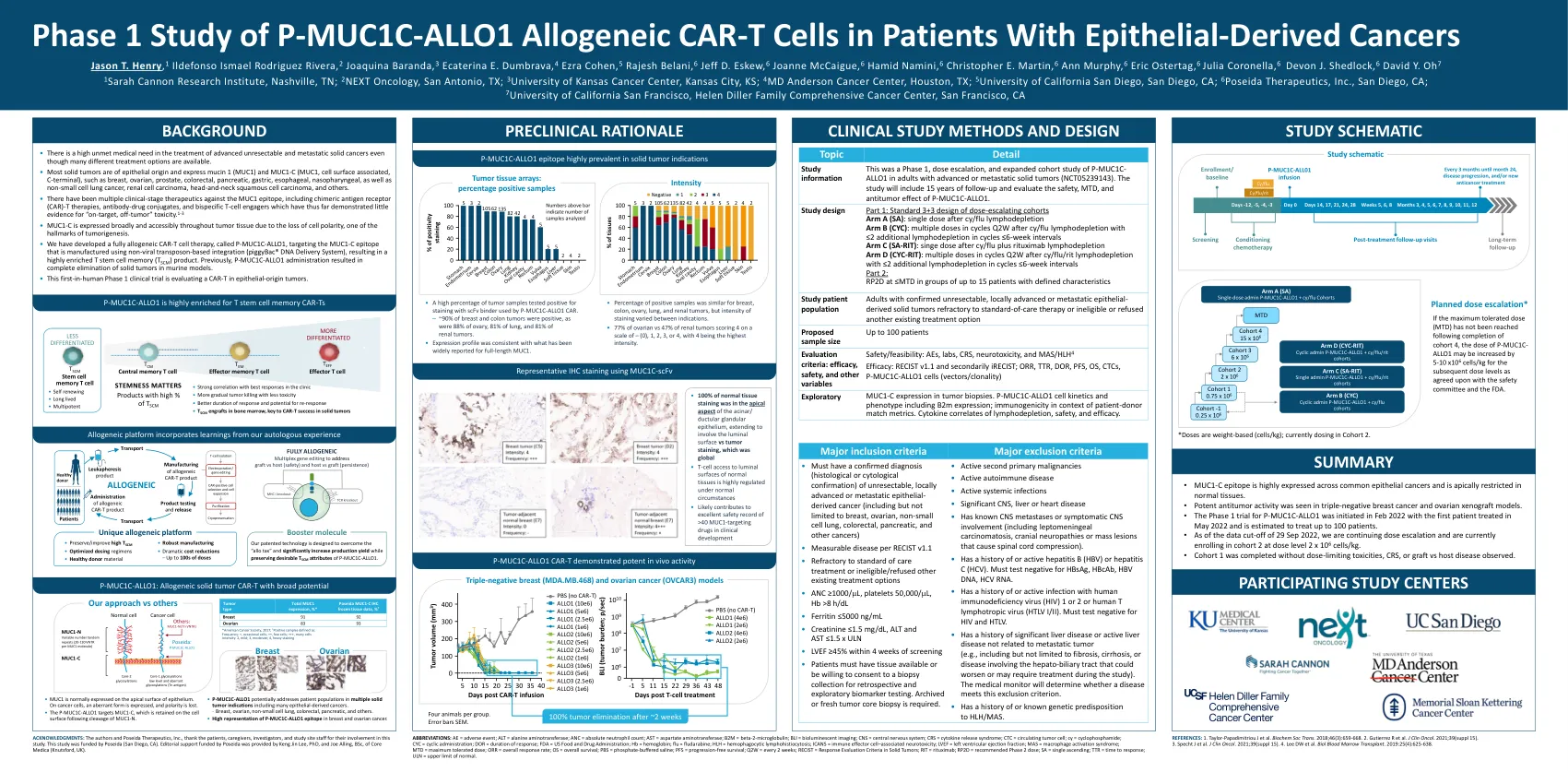
背景 晚期不可切除和/或转移性癌症患者迫切需要治疗。粘蛋白 1 (MUC1) 是一种特征明确的异二聚体糖蛋白,在许多上皮源性肿瘤中过表达,由非共价连接的 N 端 (MUC1-N) 和 C 端 (MUC1-C) 单体组成。MUC1-C 表位选择性地出现在乳腺癌、结直肠癌、卵巢癌、胃癌、肺癌等上皮源性实体瘤中。由于细胞极性的丧失,MUC1-C 也广泛且易于在整个肿瘤组织中表达,这是肿瘤发生的标志之一。 P-MUC1C-ALLO1 是一种针对 MUC1-C 表位的完全同种异体 CAR-T,采用非病毒转座子整合(piggy-Bac ® DNA 递送系统)制造,可产生高度富集的 T 干细胞记忆 (T SCM) 产品。它含有 3 个转基因:基于抗 MUC1-C 人源化 scFv 的 CAR、用于提高产品同质性的 DHFR 药物选择基因和基于 iCasp9 的安全开关基因(可在需要时快速消融 CAR-T)。这些细胞使用 Cas-CLOVER ™ 位点特异性基因编辑系统进行基因编辑,通过敲除 T 细胞受体 β 链 1 基因来消除所有细胞中内源性 T 细胞受体的表达以防止移植物抗宿主 (GvH) 反应,并敲除 b2-微球蛋白基因以消除 MHC I 类的表达,从而减弱宿主抗移植物反应。在小鼠三阴性乳腺癌和卵巢癌模型中观察到 P-MUC1C-ALLO1 的临床前疗效,这为这项首次人体 (FIH) 1 期试验提供了理论依据。方法这是一项 1 期、多中心、开放标签、FIH、3+3 设计,旨在评估 P-MUC1C-ALLO1 对 RECIST 1.1 可测量且对标准治疗有抵抗力/不适合的晚期或转移性上皮源性癌症患者的作用。最多 100 名患者将被纳入 4 个单次和周期性给药组,使用两种不同的淋巴细胞清除 (LD) 方案(环磷酰胺/氟达拉滨 ± 利妥昔单抗)。每个组的计划剂量递增范围为 0.75 至 15 x 10 6 细胞/kg。本研究的主要目标包括确定最大耐受剂量 (MTD)、评估总体安全性和耐受性、初步疗效和疾病反应。探索性终点将包括 MUC1-C 肿瘤表达和与反应的相关性、P-MUC1C-ALLO1 细胞动力学和生物标志物分析,包括 MUC1 相关肿瘤标志物 CA15-3 和 CA27-29 和 CTC。结果迄今为止,已有三名患者接受了 P-MUC1C-ALLO1 治疗(食管腺癌、结直肠腺癌和乳腺癌)。迄今为止,P-MUC1C-ALLO1 治疗耐受性良好,未观察到剂量限制性毒性、CRS 或 GvH 疾病。本研究继续招募受试者,并将提供更新的数据。试验注册 NCT05239143
P-MUC1C-ALLO1 同种异体 CAR-T 细胞治疗上皮源性癌症患者的 1 期研究
缩写:AE = 不良事件;ALT = 丙氨酸氨基转移酶;ANC = 绝对中性粒细胞计数;AST = 天冬氨酸氨基转移酶;B2M = β-2-微球蛋白;BLI = 生物发光成像;CNS = 中枢神经系统;CRS = 细胞因子释放综合征;CTC = 循环肿瘤细胞;cy = 环磷酰胺;CYC = 周期性给药;DOR = 缓解持续时间;FDA = 美国食品药品管理局;Hb = 血红蛋白;flu = 氟达拉滨;HLH = 噬血细胞性淋巴组织细胞增生症;ICANS = 免疫效应细胞相关神经毒性;LVEF = 左心室射血分数;MAS = 巨噬细胞活化综合征;MTD = 最大耐受剂量;ORR = 总有效率;OS = 总生存期;PBS = 磷酸盐缓冲盐水;PFS = 无进展生存期;Q2W = 每 2 周RECIST = 实体瘤疗效评价标准;RIT = 利妥昔单抗;RP2D = 推荐的 2 期剂量;SA = 单次升序;TTR = 缓解时间;ULN = 正常上限。
同种异体和自体膜结合 IL-21 扩增 NK 细胞对慢性淋巴细胞白血病治疗的评估
其他先天免疫细胞在 CLL 治疗中的应用。因此,obinutuzumab(经过改造,改变了 Fc 区的糖基化模式,从而提高了 FcγRIIIa 结合率)已证明可在体外提高 NK 细胞 ADCC 活性,并且在临床试验中优于利妥昔单抗(糖基化正常)。3、4 然而,之前开发基于 NK 的 CLL 疗法的努力受到限制,部分原因是 CLL 细胞具有抑制 NK 细胞的强效免疫抑制作用。这种抑制通过多种机制实现,包括 NK 抑制配体、分泌损害 NK 活化的可溶性配体、免疫抑制细胞因子和低 NK 活化配体表达。5-12 这些特征共同导致广泛的 NK 功能障碍。 12-17 广义上讲,直到最近,NK 细胞疗法也受到细胞数量低以及扩增和激活这些细胞的技术不足的限制。
抑郁症与同种异体负荷相互作用,以预测中年的认知下降
ACC:前扣带回皮质ACE抑制剂:血管紧张素转化 - 酶抑制剂ACTH:增生性激素AD:阿尔茨海默氏病AL:Alzheimer病AL:同骨负载ARB:同种异体负荷ARB:血管含量障碍物BBB:血脑箱bb:血脑屏障bbdnf:Brain-Brain brain brine brim oss brim oss brim oss brm optrect rm oppripic insrex-brm optrect insrex insrex insrex insrex insrex insrex insrex insrex-brm optrip rmm iptrectict: Test of Adult Cognition by Telephone CBF: cerebral blood flow CIDI-SF: Composite International Diagnostic Interview short-form CNS: Central nervous system CRH: Corticotropin-releasing hormone CRP: C-reactive protein cSVD: cerebral small vessel disease DBP: diastolic blood pressure DHEA-S: dehydroepiandrosterone sulfate DSM-III-R: Diagnostic and Statistical Manual-III-Revised ELISA: enzyme-linked immunosorbent assay FIML: full information maximum likelihood HbA1c: glycated hemoglobin HDL: high-density lipoprotein HF power: high-frequency power HOMA-IR: homeostatic model assessment for insulin resistance HPA: Hypothalamic-pituitary-adrenal HRV: Heart rate variability IL-6: interleukin-6 LDL: low-density lipoprotein LF power: low-frequency power LTD: long-term depression LTP: long-term potentiation MCI: mild cognitive impairment MDD: Major depressive disorder MetS: Metabolic syndrome MIDUS: Midlife in the United States MRI: magnetic resonance imaging mRNA: messenger ribonucleic acid mTOR:雷帕霉素NAC的哺乳动物靶标:N-乙酰半胱氨酸NAC:伏抗核NSAID:非甾体类抗炎药PFC:前额叶皮层PNS:副交感神经系统:随机对照试验
药理学疗法,以防止同种异体造血干细胞移植后急性髓样白血病复发
复发是同种异性造血干细胞移植(Allo-HSCT)后急性髓样白血病(AML)患者死亡率的主要原因。不良细胞遗传学或分子危险因素以及移植时的难治性疾病或持续性可测量的残留疾病(MRD)与复发风险增加有关。Allo-HSCT后用于AML复发的救助疗法通常仅限于化学疗法,供体淋巴细胞输注和/或第二次移植,并且很少成功。有效的移植后预防性干预高风险AML可能至关重要。最常见,最有前途的方法是使用降压剂的移植后维持或在存在靶标时使用FLT3酪氨酸激酶抑制剂。此外,IDH1/IDH2抑制剂和BCL-2抑制剂与其他策略结合使用,在维护环境中是有希望的方法。在这里,我们总结了当前有关Allo-HSCT后药理学剂的先发和预防性使用的知识,以防止AML复发。
同种异体干细胞移植后针对成年患者的疫苗接种指南
• DTaP (Daptacel = Diphtheria/Tetanus/acellular Pertussis) • Haemophilus Influenzae type B (HiB) • Pneumococcal conjugate 20-valent vaccine (PCV20) • Hep A • Hep B • Meningococcal conjugate vaccine • Recombinant Zoster (shingles) vaccine (Shingrix) •流感(可注射)•可以同时给予灭活疫苗。可以推迟接受超过20 mg泼尼松的患者(一种使疫苗无效的类固醇)。•每年进行流感疫苗。可以在秋季和移植后4-6个月内给出。如果提早(6个月之前),则需要在6个月后给予第二剂。