XiaoMi-AI文件搜索系统
World File Search System遗传和遗传性遗传性因素和奇异性癌症Calina Helena helena helena helena helena helena paiva de barros de barros de sout>供应链管理中的ICE
文献综述摘要对骨整合是牙科植入物成功的重要因素,从而确保在结构和功能水平上直接形成骨骼。几个因素影响了这一过程,包括手术技术,假体类型,生物材料和患者的全身状况。维生素D在维持骨代谢,有利于成骨细胞活性和钙的吸收(骨整合的基本因素)中起关键作用。这项研究进行了书目审查,以分析血清维生素D水平与牙科植入物的成功之间的关系。这项研究是在PubMed和Lilacs数据库中进行的,使用特定的描述符以及严格的包含和排除标准,从而选择了2020年至2025年之间发表的19个相关文章。结果表明,维生素D缺乏症与植入物失败的发生率更高,对初始稳定性和骨再生产生负面影响。研究表明,维生素D(<20 ng/ml)水平不足的患者的早期植入剂衰竭率较高。另一方面,补充维生素D被证明是有益的,促进了更有效的骨整合并减少并发症,尤其是在糖尿病和骨质疏松症等合并症的患者中。尽管补充维生素D的好处是广泛认可的,但文献仍然缺乏有关理想剂量和补充时间的标准化方案。关键词:维生素D,骨整合,牙科植入物。鉴于此,应将对血清维生素D水平的术前筛查纳入临床实践,以优化牙齿结果并最大程度地减少衰竭。未来的研究需要定义有关维生素D在植入学中作用的更强大的临床指南。
果糖与葡萄糖:调节间充质干细胞生长和细胞因子
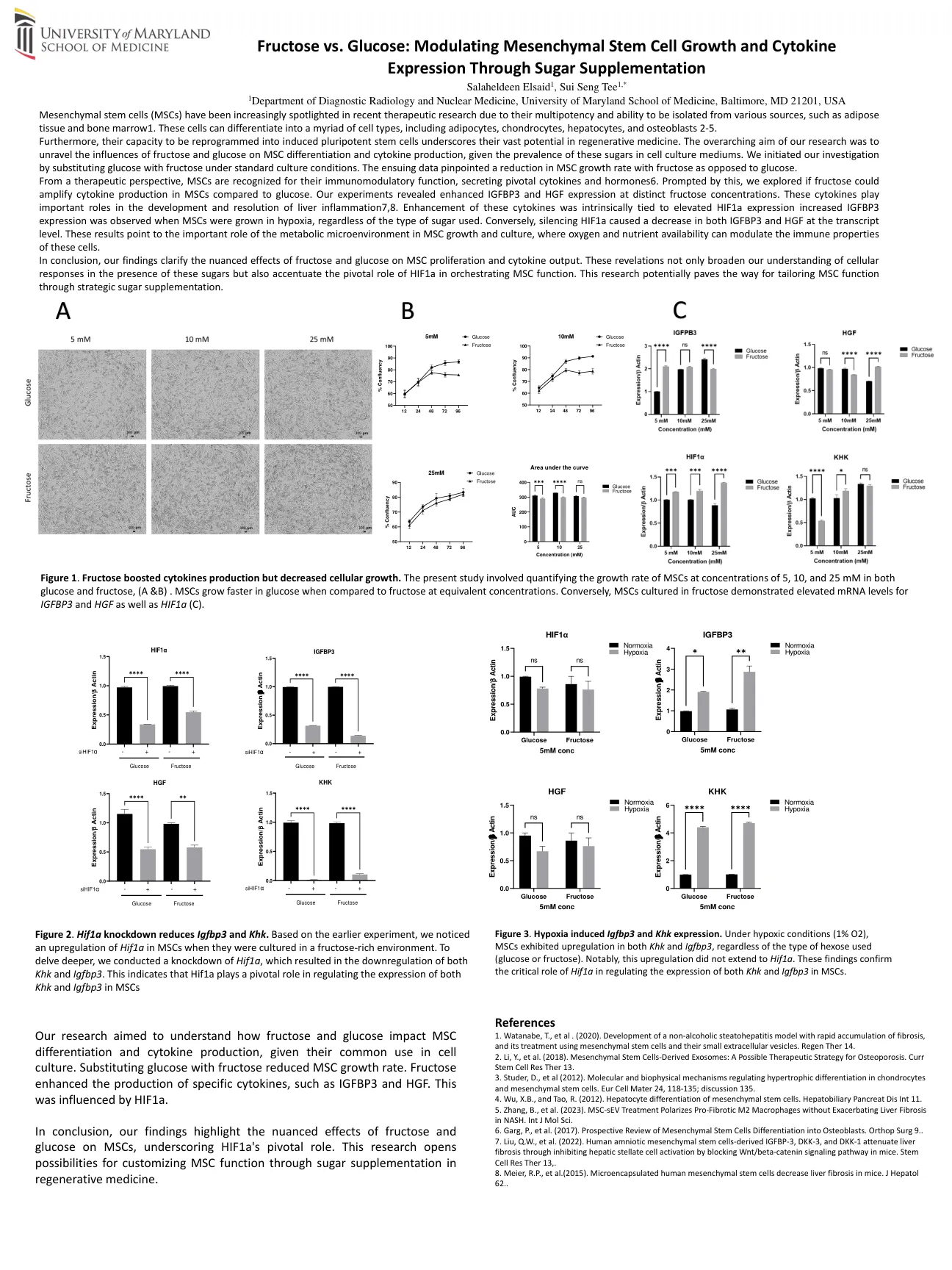
1马里兰大学医学院诊断放射学和核医学系,巴尔的摩,马里兰州,马里兰州21201,美国,美国间质干细胞(MSC),在最近的治疗研究中,由于其多能力和与各种来源隔离的能力,例如脂肪组织和骨Marrow1。这些细胞可以分化为无数细胞类型,包括脂肪细胞,软骨细胞,肝细胞和成骨细胞2-5。此外,将其重新编程为诱导多能干细胞的能力强调了其在再生医学中的巨大潜力。我们的研究的总体目的是揭示果糖和葡萄糖对MSC分化和细胞因子产生的影响,鉴于这些糖在细胞培养基中的流行率。我们通过在标准培养条件下用果糖代替葡萄糖来开始研究。随后的数据指出了果糖而不是葡萄糖的MSC生长速率降低。从治疗的角度来看,MSC因其免疫调节功能而被认可,分泌关键的细胞因子和激素6。在此提示的情况下,我们探讨了与葡萄糖相比,果糖是否可以扩增MSC中的细胞因子产生。我们的实验表明,在不同的果糖浓度下,IGFBP3和HGF表达增强。这些细胞因子在肝脏炎症的发育和解决中起着重要作用7,8。这些细胞因子的增强本质上与HIF1A表达升高相关,而当MSC在缺氧中生长时,就会观察到IGFBP3表达,无论使用的糖类型如何。相反,沉默的HIF1A在转录级别导致IGFBP3和HGF的降低。这些结果表明,代谢微环境在MSC生长和培养中的重要作用,其中氧气和养分的可用性可以调节这些细胞的免疫特性。总而言之,我们的发现阐明了果糖和葡萄糖对MSC增殖和细胞因子输出的细微影响。这些启示不仅扩大了我们在存在这些糖的情况下对细胞反应的理解,而且还强调了HIF1A在策划MSC功能中的关键作用。这项研究可能为通过补充战略糖来量身定制MSC功能铺平了道路。
骨病与治疗
骨质疏松症(OP)是老年常见的退行性疾病,以骨量减少、骨组织结构破坏为特征。骨骼在人体中具有支撑机体、调节代谢、造血等重要作用,在整个机体的生命活动中起着至关重要的作用[1]。因此,骨代谢失衡可能导致OP,进而增加骨折的风险。根据国际骨质疏松基金会的数据,全球每年有超过890万人因OP而骨折,因此对OP疾病的研究至关重要。目前,研究人员正在探索OP的发病机制,寻找更有效的预防和治疗靶点。OP的治疗前景广阔,寻找增加骨形成和维持骨强度的方法,探索治疗靶点在骨发育中的作用及其调控机制,有望成为改善OP疾病的潜在新药靶点。OP是影响老年人生活质量的主要因素之一。临床上,抗骨质疏松药物通常包括促进骨量恢复的骨吸收抑制剂,包括雌激素、降钙素和双膦酸盐 [2]。治疗骨质疏松症的新型药物之一是地诺单抗,这是一种抑制 RANKL 并阻止破骨细胞发育的人源化单克隆抗体。OPG 是一种天然存在的 RANKL 假受体,是一种用于预防和治疗骨质疏松症的基因药物;它与 RANKL 结合以抑制破骨细胞形成,减缓骨量流失并增加骨矿物质密度。OPG 可增加骨矿物质密度并防止小鼠在失重状态下骨骼分解。OPG 已被证明可在小鼠静止不动时防止骨溶解并保持骨骼形成。半胱氨酸蛋白酶、组织蛋白酶 K (Ctsk) 抑制剂(如 Odanacatib (MK0822) 等)等具有骨骼保护作用。成骨细胞和破骨细胞都负责维持动态骨稳态和骨重建[3]。
PD1/PD-L1 拮抗剂对骨重建的有利影响:一项探索性前瞻性临床研究和体外验证
摘要 背景 癌症患者的骨骼发病率对生活质量有重大影响,在改善结果的同时保持骨骼健康是现代抗肿瘤治疗策略的重要目标。尽管免疫检查点抑制剂 (ICI) 在疾病早期阶段被广泛使用,但其对骨骼的影响仍不甚明了。在此,我们通过纵向评估癌症患者的骨转换标志物并在新型生物工程 3D 骨重建模型中进行验证,全面研究了 ICI 对骨骼健康的影响。方法进行了一项探索性纵向研究,在晚期癌症患者中,每次应用 ICI(程序性细胞死亡 1 (PD1) 抑制剂或程序性死亡配体 1 (PD-L1) 抑制剂)前 6 个月或直到病情进展之前,评估骨吸收(C 端肽,CTX)和骨形成(I 型原胶原 N 端前肽,PINP 和骨钙素,OCN)的血清标志物。为了验证体内结果,我们评估了 ICI 治疗后破骨细胞 (OC) 和成骨细胞 (OB) 的分化。此外,通过免疫组织化学、共聚焦显微镜和动态 3D 骨模型中的蛋白质组学分析评估它们对骨重建的影响。结果在治疗的第一个月,CTX 水平急剧下降但时间短暂。相反,我们观察到 4 个月治疗后血清 PINP 和 OCN 水平延迟增加。在体外,ICI 通过抑制 STAT3/NFATc1 信号传导(但不抑制 JNK、ERK 和 AKT)来损害破骨细胞前体的成熟,同时对成骨没有任何直接影响。然而,使用我们的生物工程 3D 骨模型,该模型能够同时分化 OB 和 OC 前体细胞,我们证实了暴露于 ICI 时 OC/OB 活性的解偶联,这是通过展示 OC 成熟受损以及 OB 分化增加来实现的。结论我们的研究表明,抑制 PD1/PD-L1 信号轴会干扰骨转换,并可能通过间接促进成骨对骨骼发挥保护作用。
肠道轴研究:揭示了肠道菌群对绝经后骨质疏松症和骨细胞的影响
绝经后骨质疏松症(PMOP)是一种全身性骨骼状况,其特征是骨骼质量降低,骨组织的微体系结构恶化,骨骼脆弱性的增加以及由于绝经后雌激素缺乏效率而导致的骨折易感性。主要影响中年和老年妇女,它是导致其裂缝风险升高的重要因素。骨质疏松症的诊断在骨密度测量上取决于骨密度测量,主要通过双能量X射线吸收率(DEXA)扫描,这精确地测量了脊柱和髋关节的骨密度(1)。流行病学研究强调了绝经后妇女的骨质疏松症随着年龄的增长而升级。在全球范围内,超过50岁及以上的女性中有三分之一可能由于剩余一生中至少发生了一次骨折。骨折不仅增加了死亡率的风险,而且严重损害了患者的生活质量和独立性,从而施加了显着的社会和家族负担。因此,骨质疏松症的预防和管理已成为全球公共卫生问题(2)。肠道菌群是一种居住在人类胃肠道中的复杂而广阔的微生物社区,已证明通过涉及免疫系统,代谢产物和内分泌系统的各种机制在骨代谢和健康中起着至关重要的作用(3)。这些见解具有针对骨质疏松治疗的潜在治疗靶标,包括调节肠道微生物组组成或其代谢产物以增强骨骼健康。肠道微生物群和骨骼健康之间的相互作用引起了人们的关注,揭示了微生物群的参与消化,代谢,免疫功能及其对骨代谢和健康的影响通过各种机制(4)。研究发现,肠道菌群调节免疫系统功能,从而影响骨代谢和调节骨密度。对无菌小鼠模型的研究表明,缺乏肠道菌群的小鼠表现出增加的骨密度。该观察结果表明肠道菌群在调节骨代谢中起着重要作用。不存在肠道菌群似乎会影响骨吸收和形成过程,这可能是通过与免疫系统相互作用的。特别是肠道菌群可能调节破骨细胞(分解骨组织)和成骨细胞(形成形成
HES1标志着在早期骨发育中同时产生软骨细胞和围缘细胞的间充质细胞
骨骼发育始于未分化的间充质细胞的凝结,这些细胞为原始中的未来骨骼树立了框架。在内侧软骨途径中,凝结内的间充质细胞分化为SOX9依赖性机制中的软骨细胞和细胞细胞。然而,凝结外的间充质细胞的身份以及它们如何参与开发骨骼的身份仍然没有固定。在这里我们表明,凝结围绕的中囊细胞有助于软骨和peri骨,可稳健地产生骨细胞,成骨细胞和骨髓基质细胞,在发育中的骨骼中。E11.5处PRRX1-CRE标记的肢体间充质细胞的单细胞RNA-seq分析表明,Notch效应子HES1以相互排他性的方式表达,Sox9在前凝结中表达。分析Notch信号传导报告基因CBF1:H2B-Venus表明邻二碳的间充质细胞在缺口信号传导中活跃。使用HES1-creer确定的在E10.5时Sox9 +凝结周围的HES1 +早期间质细胞的在E13.5处有助于软骨和per骨,随后成为生长板软骨细胞的生长板和细胞的细胞,并在E13.5处有助于软骨和cor骨的细胞,并在e13.5处有助于软骨和细胞的细胞,并在e13.5处有助于,并在e13.5上有助于。骨头。 相比之下,HES1 +在E10.5时Sox9 +凝结周围的HES1 +早期间质细胞的在E13.5处有助于软骨和per骨,随后成为生长板软骨细胞的生长板和细胞的细胞,并在E13.5处有助于软骨和cor骨的细胞,并在e13.5处有助于软骨和细胞的细胞,并在e13.5处有助于,并在e13.5上有助于。骨头。 相比之下,HES1 +在E13.5处有助于软骨和per骨,随后成为生长板软骨细胞的生长板和细胞的细胞,并在E13.5处有助于软骨和cor骨的细胞,并在e13.5处有助于软骨和细胞的细胞,并在e13.5处有助于,并在e13.5上有助于。骨头。相比之下,HES1 +
多发性骨髓瘤的MIP1α上调RANKL ...
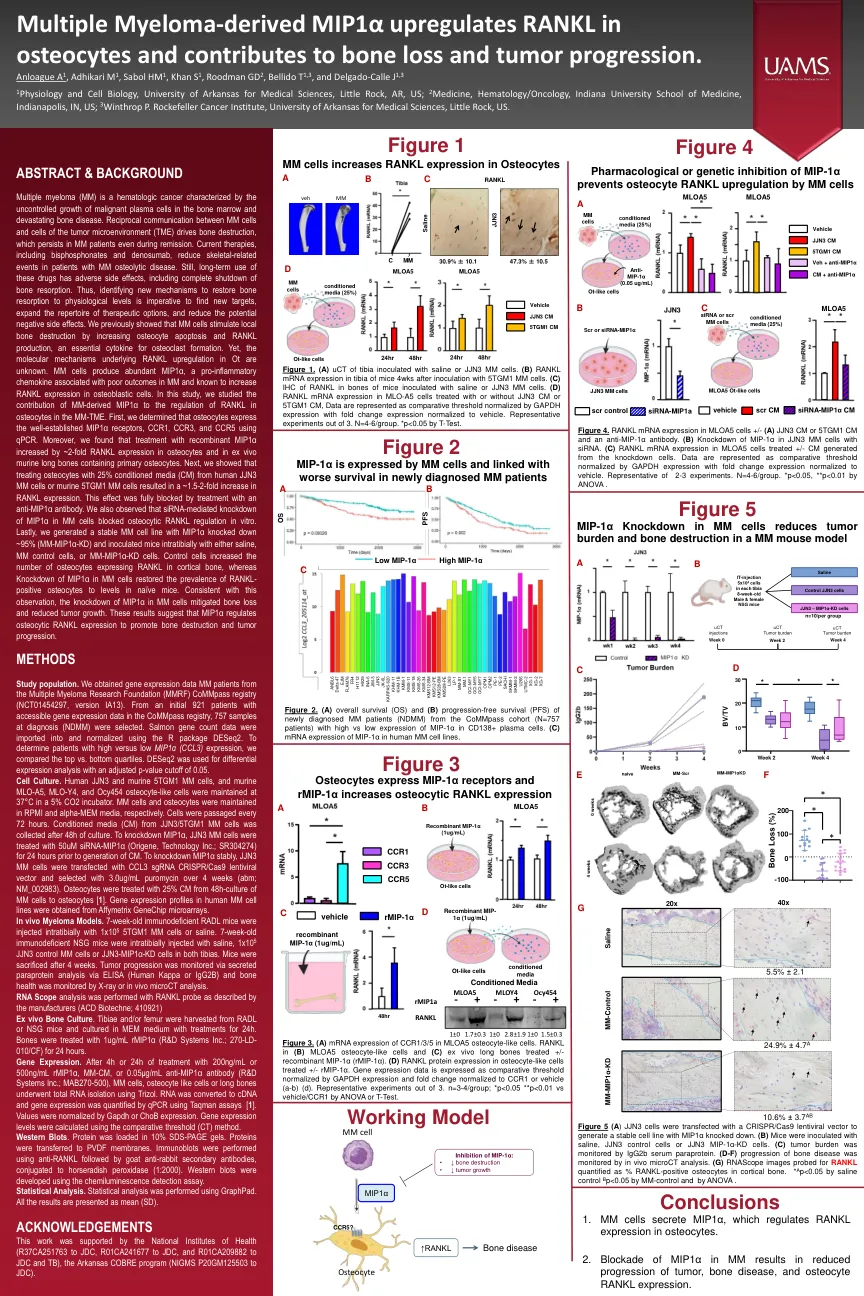
多发性骨髓瘤(MM)是一种血液学癌,其特征是骨髓和毁灭性骨病中恶性血浆细胞的生长不受控制。MM细胞与肿瘤微环境(TME)细胞之间的相互通信驱动骨骼破坏,即使在缓解过程中,MM患者也持续存在。当前的疗法,包括双膦酸盐和denosumab,减少了MM骨化疾病患者的骨骼相关事件。仍然,这些药物的长期使用具有不利的副作用,包括骨吸收的完全关闭。因此,必须确定新的机制以将骨吸收恢复到生理水平,这对于寻找新靶标,扩展治疗选择的曲目并减少潜在的负面副作用至关重要。我们先前表明,MM细胞通过增加骨细胞凋亡和RANKL产生来刺激局部骨破坏,这是破骨细胞形成的必不可少的细胞因子。然而,OT中RANKL上调的分子机制尚不清楚。mM细胞产生丰富的MIP1α,这是一种与MM结局不佳相关的促炎性趋化因子,并且已知会增加成骨细胞中RANKL表达。在这项研究中,我们研究了MM衍生的MIP1α对MM-TME中骨细胞中RANKL调节的贡献。首先,我们确定骨细胞使用qPCR表达了良好的MIP1α受体CCR1,CCR3和CCR5。此外,我们发现重组MIP1α的治疗在骨细胞和含有原发性骨细胞的离体鼠长骨中增加了约2倍的RANKL表达。接下来,我们表明,从人JJN3 MM细胞或鼠5TGM1 MM细胞中使用25%条件培养基(CM)处理骨细胞,RANKL表达增加了约1.5-2倍。用抗MIP1α抗体处理完全阻断了这种作用。我们还观察到siRNA介导的MM细胞中MIP1α的敲低阻断了体外骨细胞RANKL调节。最后,我们生成了一个稳定的MM细胞系,MIP1α击倒了〜95%(MM-MIP1α-KD),并用盐水,MM对照细胞或MM-MIP1α-KD细胞在室内接种小鼠。对照细胞增加了在皮质骨中表达RANKL的骨细胞的数量,而MM细胞中MIP1α的敲低使RANKL-阳性骨细胞的患病率恢复为幼稚小鼠的水平。与该观察结果一致,MM细胞中MIP1α的敲低减轻骨质流失和肿瘤生长减少。这些结果表明MIP1α调节骨细胞RANKL表达以促进骨骼破坏和肿瘤进展。
pleurotus sajor-caju(Fr。)歌手β-1,3- ...
摘要:可食用的灰色牡蛎蘑菇,胸膜sajor-caju,β(1,3),(1,6)葡聚糖具有广泛的生物学活性,包括抗炎性,抗炎症,抗微生物和抗氧化剂。然而,其生物学活性受到高分子重量产生的低水溶性的限制。我们先前的研究表明,使用HEVEAβ-1,3-葡萄糖酶同工酶对灰色牡蛎蘑菇β-葡聚糖进行酶水解,可获得较低的分子量和较高的水溶性,Pleurotus sajor-sajor-caju-caju葡萄糖醇乙醇(PS-GOS)。此外,PS-GOS可能通过增强成骨细胞 - 骨形成来减少骨质疏松症,而其对骨细胞 - 骨的吸收的影响仍然未知。因此,我们的研究调查了PS-GOS在核因子Kappa-B配体(RANKL)诱导的骨化前肿瘤生成264.7细胞中核因子Kappa-B配体(RANKL)诱导的破骨细胞发生上的调节活性和潜在机制。PS-GOS在RAW 264.7细胞上的细胞细胞毒性由3-(4,5-二甲基噻唑-2-基)确定-2,5-二苯基-2H-2H-四唑溴化物(MTT)测定法,其对骨酸磷酸磷酸磷酸化酶(Trapsantase)(Trappase)的影响及其对骨质分化的影响。另外,通过坑形成测定,检测到其对破骨细胞骨敏感能力的影响。通过定量逆转录酶聚合酶链反应(QRT-PCR),Western blot和免疫流效来评估破骨细胞生成相关的因子。这些发现表明PS-GOS可能是作为骨代谢疾病的有效天然剂而有益的。结果表明,PS-GOS是无毒的,并有明显地抑制成熟破骨细胞多核细胞的形成及其吸收活性,通过减少诱捕阳性细胞的数量和PIT形成区域的数量,以剂量依赖性方式。此外,PS-GOS还减轻了活化B细胞的核因子Kappa轻链增强剂的核因子p65(NFκB-P65)的表达及其随后的主骨细胞调节剂,包括活化的T细胞C1(NFATC1)的核因子和FOS Proto proto proto-cogen-(CFOS)通过NF-NF-κB-B-B-κB-B b b b b b b b b。此外,PS-GOS明显抑制了等级表达,它是许多与破骨构成相关的级联反应的初始发射器,并抑制了蛋白水解酶,包括TRAP,基质金属肽酶9(MMP-9)和Cathepsin K(CTK)。
骨科应用的医疗政策干细胞疗法
指南:•本政策未证明福利的福利或授权,这是由每个个人保单持有人条款,条件,排除和限制合同指定的。它不构成有关承保或报销/付款的合同或担保。自给自足的小组特定政策将在小组补充计划文件或个人计划决策中指导其他情况时取代该一般政策。•最重要的是通过编码逻辑软件适用于所有医疗主张的编码编辑,以评估对公认国家标准的准确性和遵守。•本医疗政策仅用于指导医疗必要性,并解释用于协助做出覆盖决策和管理福利的正确程序报告。范围:X专业_设施描述:间充质干细胞(MSC)是多功能细胞(也称为“基质多能细胞”)具有分化为多种组织类型的能力,包括器官,小梁骨,肌腱,关节骨,关节骨软骨,肌肉,肌肉,肌肉和脂肪。间充质干细胞已从骨髓经典获得,并已被证明分化为各种细胞类型,包括成骨细胞,软骨细胞,肌细胞,脂肪细胞和神经元细胞。MSC在骨科应用中的潜在用途包括治疗受损的骨骼,软骨,韧带,肌腱和椎间盘。MSC治疗的拟议益处是改善愈合,并可能避免使用持久的恢复时间进行手术程序。从理论上讲,MSC对成骨生长因子有反应,并有助于骨骼的愈合。尽管尚未建立处理技术变化,并且尚未建立要移植/种子的最佳MSC数量,但自体骨髓收集MSC浓缩以进行直接注射,或者进行培养和孵育。一旦培养了MSC,就可以与凝胶或糊状物等生物材料混合;生物材料将细胞悬挂固定,并为填充缺陷提供矩阵。MSC也可以在支架上播种,并在与植入的支撑矩阵一起使用(例如,组织工程)时进行了研究。尽管如此,评估使用MSC来增强骨骼愈合的发表的经过同行评审的科学文献中的证据主要包括动物试验和人类试验的匮乏。目前,单独使用时,证据不足以支持改善临床结果,添加到其他生物材料中,或在支持基质上培养/种子。
基于体素的形态测量揭示阿尔茨海默病中骨矿物质密度损失与皮质灰质体积减少之间的相关性
骨质疏松症和阿尔茨海默病 (AD) 都是全球性问题,尤其是在老龄人口比例不断增长的发达国家。骨质疏松症和 AD 都会随着年龄的增长而增加,缩短预期寿命 ( Yoshimura 等人,2009 年;Compston 等人,2019 年)。在 AD 中,在计算机断层扫描 (CT)、磁共振成像 (MRI) 和单光子发射断层扫描 (SPECT) 等成像方式上可识别出大脑特定区域的萎缩或低灌注。这些发现是诊断 AD 患者的重要客观生物标志物 ( Ito 等人,2014 年),意味着参与认知功能的神经网络已被破坏。流行病学研究表明,面积骨密度 (BMD) 降低和骨质流失率增加与认知能力下降和 AD 风险增加有关( Yaffe 等,1999;Zhou 等,2014;Kang 等,2018;Lv 等,2018)。这种关系的一种解释是,全身稳态依赖于器官之间的串扰,这种串扰对于协调器官活动和确保其生理功能的适当调节至关重要。在这些观点中,最近出现了骨骼和大脑之间的相互作用,即所谓的“骨-脑串扰”( Rousseaud 等,2016)。骨骼不仅调节磷酸盐和钙的代谢,还分泌一种成骨细胞衍生的分子(例如骨钙素),这种分子似乎是通过调节大脑发育和认知功能来影响中枢神经系统的重要因素(Obri et al., 2018)。目前的研究报告称,低 BMD 与早期 AD 的全脑体积较小和记忆力缺陷有关,这表明与 AD 相关的中枢神经系统退化可能在骨质流失中发挥作用(Loskutova et al., 2009; Bae et al., 2019)。在之前使用脑 SPECT 灌注图像的研究中,我们证实了患有骨质减少和 AD 的老年女性的后扣带皮层存在低灌注(Takano et al., 2020)。尽管一些实质性报告表明骨质疏松症与 AD 之间存在关系,但与人类骨质流失相关的大脑具体地形特征尚未得到广泛描述。尤其是骨质流失是否会影响 AD 相关区域(例如海马、海马旁回、颞顶区、后扣带回和楔前叶)的区域结构改变仍不清楚。因此,我们假设,更好地了解骨质流失与 AD 相关区域地形变化之间的关联将为有效预防和治疗骨质疏松症和 AD 提供策略。