XiaoMi-AI文件搜索系统
World File Search System事先授权/医疗必要性
Xeljanz/Xeljanz XR(托法替尼)是一种 Janus 激酶 (JAK) 抑制剂,用于治疗对一种或多种肿瘤坏死因子 (TNF) 阻滞剂反应不足或不耐受的中度至重度活动性类风湿性关节炎成年患者。它可以作为单一疗法使用,也可以与甲氨蝶呤或其他非生物抗风湿药 (DMARD) 联合使用。1 常用于治疗类风湿性关节炎的非生物 DMARD 包括甲氨蝶呤、来氟米特和柳氮磺吡啶。2,3 Xeljanz/Xeljanz XR 还适用于治疗对一种或多种 TNF 阻滞剂反应不足或不耐受的活动性银屑病关节炎、活动性强直性脊柱炎和中度至重度活动性溃疡性结肠炎的成年患者。 Xeljanz/Xeljanz 口服液适用于治疗对一种或多种 TNF 阻滞剂反应不足或不耐受的 2 岁及以上患者的活动性多关节型幼年特发性关节炎。使用限制:不建议将 Xeljanz/Xeljanz XR/Xeljanz 口服液与生物 DMARD 或强效免疫抑制剂(如硫唑嘌呤和环孢菌素)联合使用。2. 覆盖标准 a:A. 类风湿性关节炎 (RA)
滑膜细胞靶向治疗与TNF产生协同作用...
成纤维细胞样滑膜细胞 (FLS) 是促进类风湿性关节炎 (RA) 病理的关节衬里细胞。目前的疾病改良抗风湿药物 (DMARD) 通过全身免疫抑制起作用。针对 FLS 的方法可能与 DMARD 相结合,以改善对 RA 的控制,而不会增加免疫抑制。在这里,我们评估了免疫球蛋白样结构域 1 和 2 (Ig1&2) 用于 RA 治疗的潜力,这是一种激活 FLS 上的受体酪氨酸磷酸酶 sigma (PTPRS) 的诱饵蛋白。我们报告 PTPRS 表达在滑膜衬里 RA FLS 中富集,并且 Ig1&2 减少了 RA 的迁移,但不减少骨关节炎 FLS 的迁移。施用 Fc 融合 Ig1&2 可减轻小鼠的关节炎,而不会影响先天或适应性免疫。此外,PTPRS 在 FLS 中通过磷脂酰肌醇 3-激酶介导的途径被肿瘤坏死因子 (TNF) 下调,而 TNF 抑制会增强关节炎关节中 PTPRS 的表达。无效剂量的 TNF 抑制剂和 Fc-Ig1&2 的组合可逆转小鼠的关节炎,为 FLS 靶向疗法和免疫抑制 DMARD 疗法之间的协同作用提供了一个例子。
新消息:安大略省公共资助的肺炎球菌疫苗计划发生变化
1. 无脾(功能性或解剖性)、脾功能障碍 2. 涉及免疫系统任何部分的先天性(原发性)免疫缺陷,包括 B 淋巴细胞(体液)免疫、T 淋巴细胞(细胞)介导的免疫、补体系统(备解素或因子 D 缺乏)或吞噬功能 3. 艾滋病毒感染 4. 免疫抑制治疗,包括长期使用全身性皮质类固醇、化疗、放射治疗、器官移植后治疗、某些抗风湿药物和其他免疫抑制治疗 5. 恶性肿瘤,包括白血病和淋巴瘤 6. 镰状细胞病和其他镰状细胞血红蛋白病 7. 实体器官或胰岛细胞移植接受者 8. 任何原因导致的肝硬化 9. 慢性肾病,包括肾病综合征 10. 慢性心脏病 11. 慢性肝病,包括乙型和丙型肝炎 12.慢性呼吸系统疾病,不包括哮喘,但接受高剂量皮质类固醇治疗的患者除外 13. 可能损害口腔分泌物清除的慢性神经系统疾病 14. 糖尿病 15. 人工耳蜗植入者(植入前/植入后) 16. 慢性脑脊液漏 17. 疗养院、养老院和慢性病护理机构或病房的居民 18. 造血干细胞移植(HSCT)接受者
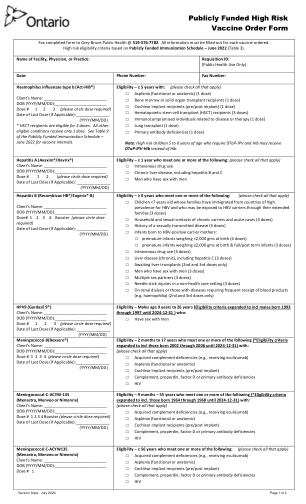
公共资助的高风险疫苗订购表
□ 无脾(解剖性或功能性)、脾功能障碍 □ 涉及免疫系统任何部分的先天性免疫缺陷,包括 B 淋巴细胞(体液)免疫、T 淋巴细胞(细胞)介导的免疫、补体系统(备解素或因子 D 缺乏)或吞噬功能 □ HIV □ 造血干细胞移植 (HSCT)(接受者) □ 免疫抑制疗法,包括长期使用皮质类固醇、化疗、放射疗法、器官移植后疗法、生物制剂和某些抗风湿药物 □ 恶性肿瘤,包括白血病和淋巴瘤 □ 镰状细胞病或其他血红蛋白病 □ 实体器官或胰岛细胞移植(接受者) □ 慢性心脏病 □ 慢性脑脊液漏 □ 糖尿病 □ 慢性肝病,包括乙肝和丙肝 □ 任何原因导致的肝硬化病因 □ 慢性肾病,包括肾病综合症 □ 慢性呼吸道疾病,不包括哮喘,但接受高剂量皮质类固醇治疗的患者除外 □ 可能影响口腔分泌物清除的慢性神经系统疾病 □ 疗养院、养老院、慢性病护理机构或病房的居民 □ 人工耳蜗(植入前/植入后)– 仅适用于年龄 <65 岁的人 IPV、Tdap-IPV、Td-IPV 客户姓名:_____________________________ 出生日期(年/月/日):______________________________________ 第 1 剂 最后一次接种日期(如适用):_______________(年/月/日)
美国风湿病学会关于 Janus 激酶抑制剂的黑框警告声明
JAK 抑制剂 [托法替尼 (Xeljanz/Xeljanz XR)、巴瑞替尼 (Olumiant) 和乌帕替尼 (Rinvoq)] 是靶向合成的疾病改良抗风湿药物 (DMARD),广泛用于治疗类风湿关节炎 (RA) 和银屑病关节炎 (PsA),其中托法替尼最近被批准用于治疗强直性脊柱炎 (AS) 和多关节型幼年特发性关节炎 (pcJIA)。2021 年 ACR RA 临床实践指南建议对甲氨蝶呤无反应者添加生物制剂或靶向合成的 DMARD,例如 JAK 抑制剂。[1] 然而,该指南指出了潜在的新出现的安全信号,并预计 FDA 强制要求对 RA 患者进行长期前瞻性开放标签非劣效性安全性临床试验的结果即将公布。这项研究最近完成,对比了两种剂量的托法替尼(5 毫克和 10 毫克,每日两次)与抗肿瘤坏死抑制剂 (TNFi)(阿达木单抗和依那西普)的效果,两个共同主要终点是主要不良心脏事件 (MACE) 和恶性肿瘤。这项国际研究针对 4,362 名年龄超过 50 岁且至少有一个额外心血管风险因素的 RA 患者进行。
Cimzia® (Certolizumab Pegol) – 商业医疗福利药物政策
对于初始治疗,需要满足以下所有条件: o 诊断为中度至重度活动性类风湿性关节炎;并且 o 以下情况之一: 对一种非生物抗风湿药物 (DMARD) [例如甲氨蝶呤、来氟米特、柳氮磺吡啶、羟氯喹] 最大剂量 3 个月试验失败且不耐受的病史,除非出现禁忌症或临床上显着的不良反应;或 患者之前曾接受过 FDA 批准用于治疗类风湿性关节炎的靶向免疫调节剂治疗 [例如 Enbrel (依那西普)、Simponi (戈利木单抗)、Orencia (阿巴西普)、阿达木单抗、Xeljanz (托法替尼)、Olumiant (巴瑞替尼)、Rinvoq (upadacitinib)];或 患者目前正在使用 Cimzia,并且 o 根据美国 FDA 标示的 RA 剂量开始和滴定 Cimzia;并且 o 患者未同时接受 Cimzia 与靶向免疫调节剂 [例如 Enbrel(依那西普)、Simponi(戈利木单抗)、Orencia(阿巴西普)、阿达木单抗、Xeljanz(托法替尼)、Olumiant(巴瑞替尼)、Rinvoq(乌帕替尼)] 的联合治疗;并且 o 由风湿病专家开具处方或咨询风湿病专家;并且 o 初始授权有效期为 12 个月
接受免疫抑制靶向治疗的一系列慢性关节炎患者的 COVID-19 临床病程
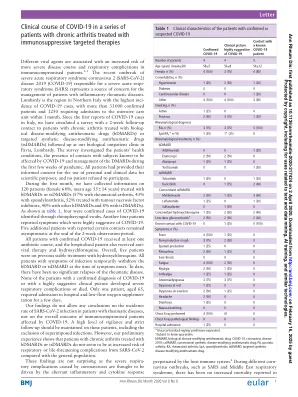
不同的病毒因子与免疫功能低下患者病情加重和呼吸系统并发症的风险增加有关。1–3 最近爆发的严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 疾病 2019 (COVID-19) 导致严重急性呼吸综合征 (SARS),这引起了对炎症性风湿病患者管理的担忧。伦巴第大区是意大利北部 COVID-19 病例发病率最高的地区,确诊患者超过 33,000 例,1,250 例患者在 1 个月内需要进入重症监护室。自意大利首次报告 COVID-19 病例以来,我们已对在伦巴第大区帕维亚的生物门诊接受生物抗风湿药物 (bDMARDs) 或靶向合成抗风湿药物 (tsDMARDs) 治疗的慢性关节炎患者进行了为期两周的随访调查。调查内容包括患者的健康状况、与已知受 COVID-19 影响的受试者的接触情况以及在疫情爆发的头几周内对 DMARDs 的管理情况。所有患者均已知情同意将个人和临床数据用于科学目的,并且没有患者拒绝参与。在第一个月内,我们收集了 320 名接受 bDMARDs 或 tsDMARDs 治疗的患者(女性占 68%,平均年龄 55±14 岁)的信息(57% 患有类风湿性关节炎,43% 患有脊柱关节炎,52% 接受肿瘤坏死因子抑制剂治疗,40% 接受其他 bDMARDs 治疗,8% 接受 tsDMARDs 治疗)。如表 1 所示,四例是通过鼻咽拭子发现的 COVID-19 确诊病例。另有四名患者报告的症状高度提示是 COVID-19。另外五名报告有某些接触的患者在两周观察期结束时仍无症状。所有确诊的 COVID-19 患者均接受了至少一疗程的抗生素治疗,住院患者还接受了抗病毒治疗和羟氯喹治疗。总体而言,五名患者之前均接受过羟氯喹的稳定治疗。所有出现感染症状的患者在症状出现时均暂时停用 bDMARD 或 tsDMARD。迄今为止,风湿病没有出现明显复发。确诊为 COVID-19 或临床表现高度可疑的患者均未出现严重呼吸道并发症或死亡。只有一名 65 岁患者需要住院并接受几天的低流量吸氧。我们的研究结果无法得出有关风湿病患者 SARS-CoV-2 感染发病率的任何结论,也无法得出有关 COVID-19 免疫功能低下患者的总体结果的任何结论。应对这些患者保持高度警惕并严格随访,包括排除叠加感染。然而,我们的初步经验表明,与普通人群相比,使用 bDMARDs 或 tsDMARDs 治疗的慢性关节炎患者似乎不会因 SARS-CoV-2 而增加呼吸道或危及生命的并发症的风险。这些发现并不令人惊讶,因为冠状病毒引起的严重呼吸道并发症被认为是由异常的炎症和细胞因子反应引起的
托法替尼(XELJANZ)在强直性脊柱炎国家...
• 患者患有活动性强直性脊柱炎,根据巴斯强直性脊柱炎疾病活动指数 (BASDAI) 和 BASDAI 背痛评分均为 ≥ 4(尽管服用了 ≥ 2 种 NSAID)或对 NSAID 不耐受。已接受口服糖皮质激素或抗风湿药物 (DMARD) 治疗的患者,如果剂量稳定,可以参加试验。• 在 270 名随机患者中,91% 为男性,79% 为白人,约 10% 来自北美,39% 来自欧盟,23% 来自亚洲,31% 来自其他国家。患者平均年龄约为 41 岁。• 几乎所有患者 (99.7%) 都曾使用过 NSAID,77% 未使用过生物 DMARD,1.1% 曾使用过生物 DMARD 但反应不佳。 62 名患者(23%)对不超过两种 TNFI 反应不足或曾使用过生物 DMARD 治疗(包括 TNFI)但反应不足,其中分别有 43 名患者(16%)和 16 名患者(6%)对一种和两种 TNFI 反应不足。• 排除当前或既往使用针对性合成 DMARD(包括 JAKI)治疗和当前生物 DMARD 治疗的患者。• 稳定剂量的 NSAID、甲氨蝶呤(≤ 25 mg/周)、柳氮磺吡啶(≤ 3 g/天)和口服糖皮质激素(≤ 10 mg/天泼尼松当量)可继续作为背景疗法。在第 1 天,约 80% 的患者使用 NSAID,8% 使用口服糖皮质激素,27% 的患者同时使用常规合成免疫调节剂(甲氨蝶呤或柳氮磺吡啶)。
炎症性疾病 - Olumiant 事先授权政策
强效局部皮质类固醇和/或全身皮质类固醇。类固醇减量疗法可减轻长期使用皮质类固醇带来的风险,包括环孢菌素、甲氨蝶呤和硫唑嘌呤。• COVID-19:美国传染病学会 (IDSA) 和美国国立卫生研究院 (NIH) 制定了 COVID-19 治疗指南;两项指南均涉及 Olumiant 的使用。3,4 IDSA 和 NIH 指南均建议住院的 COVID-19 患者使用 Olumiant 持续 14 天或直至出院。• 类风湿性关节炎:美国风湿病学会 (2021) 指南建议对于服用最大耐受剂量甲氨蝶呤但未达到目标剂量的患者,添加生物制剂或靶向合成的改善病情的抗风湿药 (DMARD)。 2 政策声明 建议对 Olumiant 的处方福利覆盖进行事先授权。所有批准的有效期如下。如果批准以月为单位,则 1 个月等于 30 天。由于评估和诊断接受 Olumiant 治疗的患者需要专业技能,并且需要监测不良事件和长期疗效,某些适应症的初步批准需要由专门治疗所治疗病症的医生开具 Olumiant 处方或与其会诊。所有关于在住院 COVID-19 患者中使用 Olumiant 的请求都将转发给医学主任。值得注意的是,这包括与 COVID-19 相关的细胞因子释放综合征的请求。
接受分子靶向治疗的类风湿关节炎患者罹患带状疱疹的风险不同:一项单中心研究
目的:探讨日本现实临床实践中接受生物或靶向合成抗风湿药物 (b/tsDMARDs) 治疗的类风湿关节炎 (RA) 患者罹患带状疱疹 (HZ) 的风险。方法:纳入 2006 年至 2019 年接受甲氨蝶呤 (MTX) 和 b/tsDMARDs 治疗的 974 名 RA 患者,仅接受 MTX 治疗的患者作为对照组。使用倾向评分匹配调整患者背景,以确定罹患 HZ 的风险因素。结果:共分析了 899 名患者。在接受 b/tsDMARDs 治疗的患者中,接受 Janus 激酶 (JAK) 抑制剂治疗的患者 HZ 感染发生率最高。多变量分析发现,与单独使用 MTX 治疗相比,JAK 抑制剂与 MTX 联合治疗是发生 HZ 的风险因素(风险比 [HR],4.72;95% 置信区间 [CI],1.20 − 18.6)。患者背景调整显示,与未使用 MTX 的患者相比,使用 JAK 抑制剂或肿瘤坏死因子抑制剂与 MTX 联合治疗的患者发生 HZ 的风险更高(HR,1.32;95% CI,0.50 − 3.49)。结论:JAK 抑制剂是发生 HZ 的风险因素,在日本 RA 患者中,不同的 b/tsDMARD 和 MTX 组合与发生 HZ 的风险不同相关。