XiaoMi-AI文件搜索系统
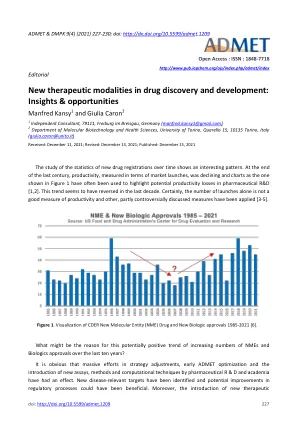
World File Search System药物发现和开发中的新治疗方式:见解和机遇
抗体、抗体-药物偶联物、融合蛋白、神经毒素、肽、聚合物、小干扰 RNA、疫苗等正在进入市场。此外,所谓的“超越五化合物规则”(bRo5)的引入表明,即使对于一些要求苛刻的靶标,也可以设计和优化较大的化合物(MW >> 500),以具有足够的 ADMET 特征并产生具有所需体内效果的生物利用度。虽然尚未报道设计口服生物可利用 bRo5 候选药物的一般策略,但构象灵活性已被确定为描述大型柔性衍生物的 ADME 特征的重要参数。例如,最近有研究表明,灵活性描述符有助于改善 bRo5 化合物的计算溶解度预测 [8]。此外,许多 bRo5 化合物似乎具有内在的潜力,可以构象调整以适应周围介质并表现得像分子变色龙。例如,已经分析了以环境依赖性方式形成的分子内氢键,以解释一些新治疗方式的被动渗透技巧[9,10]。
DNA 脱氧核糖部分中的量子逻辑门
DNA 分子中核苷酸的脱氧核糖部分可以充当量子逻辑门,其中每个核苷酸的 C2-endo 和 C3-endo 构象之间的对映体位移发生在电子自旋量子比特的逻辑和热力学可逆情况下,这些量子比特相干地保持在拓扑绝缘的 DNA 晶体纳米结构内,并沿着 pi 堆叠核苷酸碱基对的离域电子相干地传导。C2-endo 和 C3-endo 构象之间的对映体对称性在逻辑和热力学上是可逆的,因为它充当对称性破坏的 Szilard 引擎,该引擎实际上是由其运作信息的物理性有效构建的,因此不需要信息擦除来维持功能。这种量子逻辑门类似于 Toffoli 门,它跨越适合 Landauer 极限的能量屏障运行,滚动 DNA 碱基对,从而破坏 DNA 分子片段上的 pi 堆叠相干性,从而实现信息的量子到经典转变。
在人类癌症中靶向过表达的细胞周期蛋白依赖性激酶1(CDK1):kamalachalcone A在硅docking研究中作为CDK1激酶的潜在抑制剂出现为潜在的抑制剂
受体分子的位点,然后生成对接参数文件(DPF)。这些文件用作网格映射和对接的输入文件。使用受体和配体的PDB文件用于生成PDBQT文件,以使用AutoDdock Tools 1.5.7执行对接研究。对每个配体进行了独立的运行,每个表观构象体以随机顺序对接到CDK1激酶的结合袋中。在扩展坞研究中,分配了遗传算法和lamarckian通用算法进行配体构象搜索。分析了从每个对接受体配体配合物的Autodock4对数文件(DLG)获得的数据[26]。随后,使用Ligplot+ V.4.5.3软件来计算结合位点中配体和CDK1激酶之间疏水和氢键的数量。通过Ligplot + 4.5.3软件鉴定了结合位点中存在的氨基酸的类型和数量[27]。
DNA重组技术中使用的主要酶
DNA甲基转移酶是一类催化DNA中核苷酸残基甲基化的酶。甲基转移酶的活性包括将甲基(CH3-)基团转移到DNA中的含氮碱基胞嘧啶上,这会导致DNA性质的改变,同时相应基因的活性和功能以及核酸的空间结构(构象)也会发生变化
蛋白质数据库是药物发现的金矿
摘要 蛋白质-配体结合是指小分子(药物,又称配体)与体内的受体或蛋白质结合。这种结合事件会引起生物反应,可能是减轻炎症、缓解疼痛等。通常,这种蛋白质-配体复合物可以呈现的姿势或配置数量有限(或可能只有一种)。识别这种生物活性姿势是药物发现中的巨大挑战。通常,它被认为是蛋白质或配体的最低能量姿势,但通常情况并非如此。复合物可以稳定或弥补配体的更高能量构象等。蛋白质和配体都是三维的且具有柔韧性,因此会不断改变形状。这是一个多步骤问题。从配体开始,必须识别配体的生物活性 3D 构象。然后转到蛋白质,生物活性构象是一个更大的挑战,部分原因是分子更大,可能性更多。最后,如果可以识别配体和蛋白质的生物活性构象,那么就需要将配体置于蛋白质内的正确位置和方向,以产生所需的活性。有很多方法可以生成这些姿势,也有很多方法可以尝试确定哪些姿势是正确的(或可能是正确的)。其中一些计算在计算上成本低廉,而另一些计算可能非常昂贵。解决这个问题的一种方法是使用一种相当便宜的方法生成大量潜在姿势,然后进行更昂贵的计算,按成为生物活性姿势的可能性对它们进行排序。但是,生成比人们能够承受的昂贵方法多得多的潜在姿势仍然很容易。关键词:嵌合体、五法则、配体、对接、蛋白质、药物性、spresi。
使用量子计算机进行蛋白质折叠
半个多世纪以来,蛋白质折叠一直是最困难的问题之一,随机热运动导致构象变化,从而导致能量下降到天然结构,这是漏斗状能量景观中捕获的原理。未折叠的多肽具有广泛的可能构象。由于潜在构象随链长呈指数增长,搜索问题对于经典计算机来说变得难以解决。到目前为止,有理论和实验证据表明,使用量子退火、VQE 和 QAOA 等量子计算方法解决此类优化问题具有优势。虽然谷歌的 DeepMind-AlphaFold 已经取得了很大成就,但我们可以通过量子方法走得更远。在这里,我们展示了如何使用变分量子特征求解器预测蛋白质结构以及 RNA 折叠,并使用条件风险值 (CVaR) 期望值来解决问题并找到最小配置能量,我们的任务是确定蛋白质的最小能量结构。蛋白质的结构经过优化以降低能量。还要确保满足所有物理约束,并将蛋白质折叠问题编码为量子比特算子。
水体 – 一种新型囊泡药物输送方式...
水体是最近开发的一种将生物活性分子(如肽、蛋白质、激素、抗原和基因)输送到不同部位的机制。水体呈圆形,粒径为 60300 纳米。水体是由磷酸钙或陶瓷金刚石形成的球形颗粒,涂有多羟基寡聚物薄膜,充当纳米颗粒载体网络,而不是纯纳米颗粒。它有三层自组装结构,由涂有寡聚物薄膜的固相纳米晶体核心组成,吸附有或无改性的生化活性分子……它通常用于植入物制备。水体用作红细胞替代品、病毒抗原递送疫苗和细胞内基因治疗的靶向方法。酶对分子构象的行为和响应使水体成为酶(如 DNA 和色素)的新型载体。本文讨论了自组装的概念,以及保持固定表面对的构象完整性和生化操作的困难。该输送系统成功地用于分配胰岛素、血红蛋白和酶,如沙雷氏肽酶等。
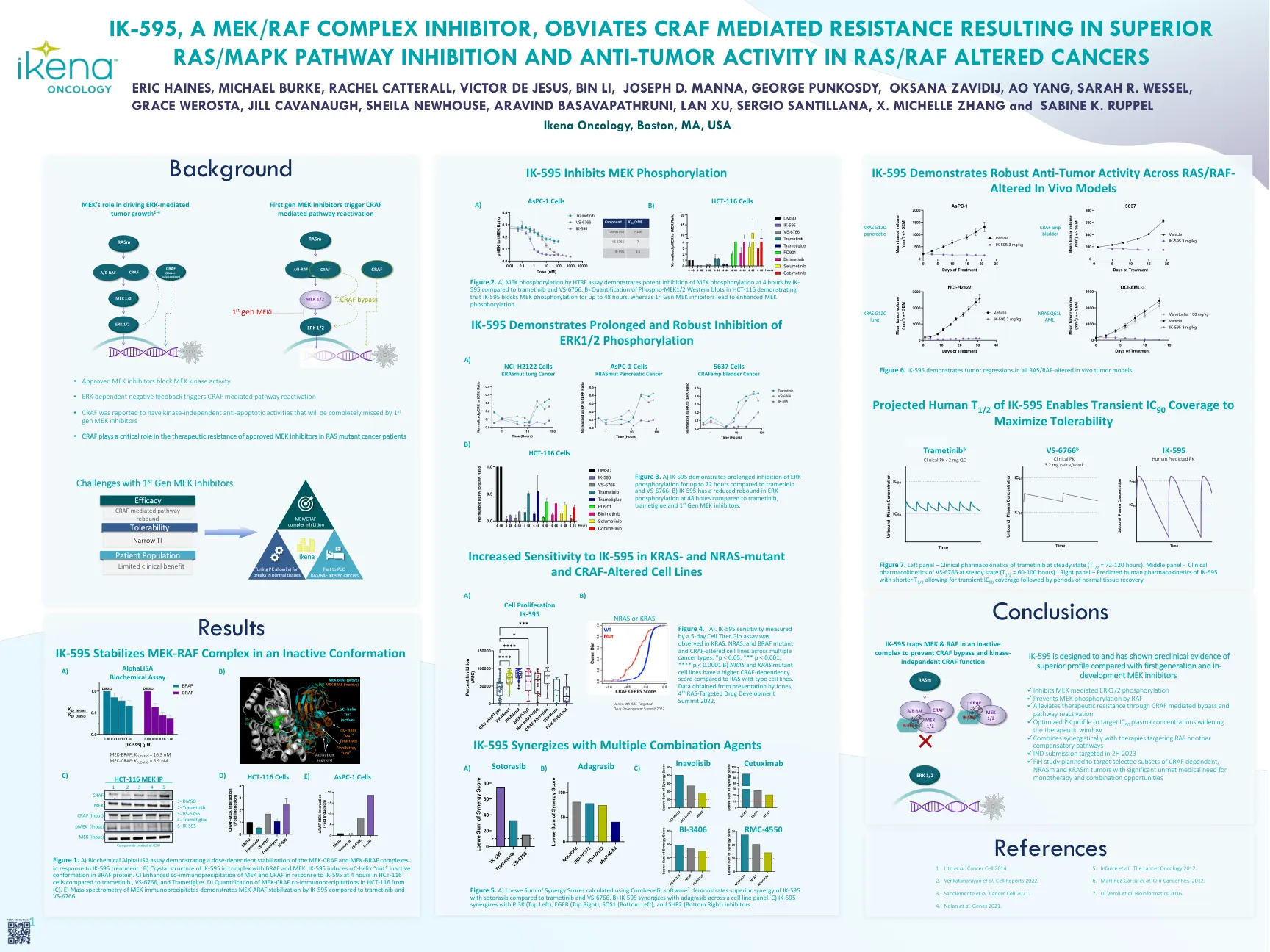
IK-595,一种MEK/RAF复合物抑制剂,避免了CRAF介导的... ik-930,一种用于治疗YAP/TAZ-TEAD依赖性癌症的Tead Paralog选择性抑制剂
图1。a)生化α分析,表明对IK-595处理的MEK-CRAF和MEK-BRAF复合物的剂量依赖性稳定。b)IK-595的晶体结构与BRAF和MEK在复合体中。IK-595在BRAF蛋白中诱导C螺旋“ OUT”无活性构象。 c)与Trametinib,VS-6766和Trametiglue相比,HCT-116细胞在HCT-116细胞中对IK-595的响应增强了MEK和CRAF的共免疫沉淀。 d)(c)中HCT-116中MEK-CRAF共免疫沉淀的定量。 e)MEK免疫沉淀物的质谱法证明了与Trametinib和VS-6766相比,IK-595的MEK-ARAF稳定。IK-595在BRAF蛋白中诱导C螺旋“ OUT”无活性构象。c)与Trametinib,VS-6766和Trametiglue相比,HCT-116细胞在HCT-116细胞中对IK-595的响应增强了MEK和CRAF的共免疫沉淀。d)(c)中HCT-116中MEK-CRAF共免疫沉淀的定量。e)MEK免疫沉淀物的质谱法证明了与Trametinib和VS-6766相比,IK-595的MEK-ARAF稳定。
抗癌药物柔红霉素直接影响基因表达和 DNA 结构
摘要:柔红霉素 (DM) 是一种蒽环类抗生素,常用于治疗各种癌症,但 DM 对基因表达和 DNA 结构的直接影响尚不清楚。我们使用一种用精胺 (SP) 优化的体外无细胞系统来研究 DM 对基因表达的影响。随着 DM 浓度的增加,观察到 DM 对基因表达的双峰效应,即微弱的促进作用随后是抑制作用。我们还进行了原子力显微镜观察,以测量 DM 如何影响 SP 诱导的 DNA 高级结构。DM 通过产生双链断裂来破坏 SP 诱导的 DNA 花状构象,这种破坏性的 DNA 构象变化与对基因表达的抑制作用相对应。有趣的是,在较低的 DM 浓度下,当 DNA 构象被拉长或松弛时,无细胞基因表达会略微增强。我们期待这些新发现的 DM 对基因表达和 DNA 高级结构的影响将进一步促进有用的抗癌治疗化学药品的开发和改进。