XiaoMi-AI文件搜索系统
World File Search SystemSOTYKTU® ▼(deucravacitinib) 处方信息
描述:薄膜包衣片,每片含 6 毫克德克拉伐替尼。 适应症:治疗适合全身治疗的成人中度至重度斑块状银屑病。 用法用量:应在有银屑病诊断和治疗经验的医生的指导和监督下开始治疗。 用法用量:每日一次,每次口服 6 毫克。如果患者在 24 周后未显示出治疗益处的证据,应考虑停止治疗。应定期评估患者对治疗的反应。 特殊人群: 老年人:65 岁及以上的老年患者无需调整剂量。≥75 岁患者的临床经验非常有限,对这类患者应谨慎使用德克拉伐替尼。 肾功能不全:肾功能不全患者无需调整剂量,包括接受透析的终末期肾病 (ESRD) 患者。肝功能损害:轻度或中度肝功能损害患者无需调整剂量。不建议对重度肝功能损害患者使用 Deucravacitinib。儿科人群:尚未确定 Deucravacitinib 对 18 岁以下儿童和青少年的安全性和有效性。没有可用数据。给药方式:口服。药片可以与食物一起或单独服用。药片应整个吞咽,不应压碎、切割或咀嚼。禁忌症:对活性物质或任何赋形剂过敏(见 SmPC)。临床上重要的活动性感染(例如活动性结核病)。警告和注意事项:感染:在感染消退或得到充分治疗之前,不应对任何临床上重要的活动性感染患者开始治疗。考虑在患有慢性感染或有复发性感染史的患者中使用时应谨慎。应指导接受德克拉伐替尼治疗的患者,如果出现提示感染的体征或症状,应寻求医疗建议。如果患者出现临床上重要的感染或对标准疗法没有反应,应仔细监测,在感染消退之前不应给予德克拉伐替尼。结核病 (TB) 治疗前评估:在开始使用德克拉伐替尼治疗之前,应评估患者是否感染结核病。不应将德克拉伐替尼给予活动性结核病患者。应在给予德克拉伐替尼之前开始潜伏性结核病治疗。对于有潜伏性或活动性结核病史且无法确认是否接受过充分治疗的患者,应在开始使用德克拉伐替尼之前考虑抗结核病治疗。应监测接受德克拉伐替尼治疗的患者是否有活动性结核病的体征和症状。恶性肿瘤*:恶性肿瘤,包括淋巴瘤和非黑色素瘤皮肤癌 (NMSC),在德克拉伐替尼的临床研究中观察到。目前可用的临床数据有限,无法评估德克拉伐替尼暴露与恶性肿瘤发展之间的潜在关系。长期安全性评估正在进行中。患者开始使用德克拉伐替尼治疗前应考虑其风险和益处**。重大不良心血管事件 (MACE)、深静脉血栓形成 (DVT) 和肺栓塞 (PE)*:在德克拉伐替尼的临床试验中未观察到风险增加。长期安全性评估正在进行中。患者开始使用德克拉伐替尼治疗前应考虑其风险和益处**。免疫接种:在开始治疗前,考虑根据当前免疫接种指南完成所有适合年龄的免疫接种。应避免对接受德克拉伐替尼治疗的患者使用活疫苗。
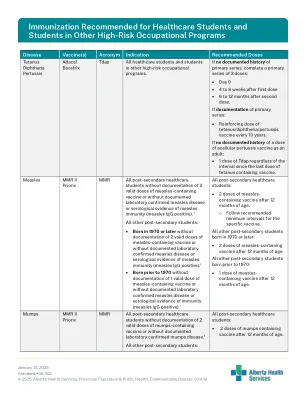
建议医疗保健专业学生和其他高风险职业项目的学生接种疫苗
结核病 Tubersol PPD 入学时对医护学生进行基线结核菌素皮肤试验 (TST) 的目的是确定那些可能在职业中接触传染病例的人员的基线 2 结核分枝杆菌 (TB) 感染状况。建议入学时对医护学生进行 TST(有活动性结核病史或先前 TST 阳性史的学生除外),如下所示:
Bio-Thera 和 Richter 签署针对 Stelara® 生物仿制药 BAT2206 的独家商业化协议,适用于欧盟国家、英国、瑞士和
“我们很高兴地宣布,Richter 在其核心商业区域建立强大的生物仿制药产品组合方面又迈出了重要一步”——Richter 生物技术业务部负责人 Erik Bogsch 博士表示。“继今年早些时候的收购和最近我们提交地舒单抗申请的消息之后,与 Bio-Thera 的当前交易加强了 Richter 在欧洲的存在和生物仿制药产品组合。”关于 BAT2206(ustekinumab)BAT2206 是杨森 Stelara® 的拟议生物仿制药,Stelara® 是一种人源单克隆抗体,通过阻止共享 p40 与免疫细胞表面表达的 IL-12Rβ1 受体蛋白结合来抑制人 IL-12 和 IL-23 的生物活性。IL-12 和 IL-23 参与炎症和免疫反应,例如自然杀伤细胞活化和 CD4+ T 细胞分化和活化。 IL-12 和 IL-23 被认为是导致克罗恩病、溃疡性结肠炎和许多其他自身免疫性疾病的慢性炎症的重要因素。在欧盟,Stelara ® 目前已获准用于治疗以下疾病:1) 中度至重度斑块状银屑病,适用于使用其他系统性(全身)银屑病治疗后病情没有改善或不能使用其他系统性(全身)银屑病治疗的成人和 6 岁以上儿童;2) 活动性银屑病关节炎,单独使用或与甲氨蝶呤联合使用,适用于使用其他称为改善病情的抗风湿药 (DMARD) 的治疗方法病情没有得到足够改善的成人;3) 中度至重度活动性克罗恩病,适用于使用其他克罗恩病治疗方法病情没有得到足够改善或不能接受此类治疗的成人;4) 中度至重度活动性溃疡性结肠炎,适用于使用其他溃疡性结肠炎治疗方法病情没有得到足够改善或不能接受此类治疗的成人。
国防部标准实践
用于确定维护要求。它适用于所有级别的系统或设备分组,以及所有计划维护,无论设备是在使用中、准备使用还是处于待命或闲置状态。RCM 涉及企业的整个计划维护计划;即组织、中级和仓库级维护,无论哪个维护层级具备执行维护的能力。RCM 方法为基于条件的维护 (CBM) 计划奠定了基础。RCM 和 CBM+ 技术之间的关系包含在附录 F 中。本标准提供了在计划维护管理系统内制定纠正性、非活动性和预防性设备维护的程序。应用本标准中概述的 RCM 程序后,可以制定特定的维护程序,以纳入级别维护计划以及仓库、中级和组织维护系统。维护(纠正性、非活动性和预防性)(分别见 3.15.3、3.16.5 和 3.16.8)是定期(定期、情境性和不定期)执行任务(条件指导、故障查找、润滑、维修和时间指导)(分别见 3.28.2、3.28.4、3.28.5、3.28.6 和 3.28.7)以确保物项的功能(主动、明显、隐藏和被动)(见 3.13.1、3.13.2、3.13.3 和 3.13.4)在需要时可用的行为。出于以下目的
足细胞病中针对 Nephrin 的自身抗体
结果 本研究纳入了 539 名患者(357 名成人和 182 名儿童)和 117 名对照者。在成人中,105 名微小病变患者中 46 名(44%)检测到抗肾上腺素自身抗体,74 名原发性局灶节段性肾小球硬化症患者中 7 名(9%)检测到抗肾上腺素自身抗体,而患有其他疾病的患者中仅少数病例检测到抗肾上腺素自身抗体。在 182 名特发性肾病综合征儿童中,94 名(52%)可检测到抗肾上腺素自身抗体。在未接受免疫抑制治疗的活动性微小病变或特发性肾病综合征患者亚组中,抗肾上腺素自身抗体的患病率分别高达 69% 和 90%。在研究纳入和随访期间,抗肾上腺素自身抗体水平与疾病活动性相关。实验性免疫在小鼠中诱发了肾病综合征、微小病变样表型、IgG 定位至足细胞裂孔隔膜、肾病蛋白磷酸化和严重的细胞骨架变化。
H1N1 和季节性流感疫苗供应情况
季节性流感疫苗现已开始提供,先到先得,并将持续到我们的库存耗尽为止。请注意,对鸡蛋或鸡蛋制品过敏、发烧和/或患有急性呼吸道疾病或其他活动性感染的员工不会接种疫苗。孕妇需要医生的授权才能接种流感疫苗。如果您想接种季节性流感疫苗,请致电 410-786-2165 联系客户服务台,以便将其列入接种疫苗的名单中。
骨髓移植失败
2 禁忌症 MMR® II(麻疹、腮腺炎和风疹病毒减毒活疫苗,Merck Std.)不应接种于: • 对疫苗的任何成分(包括明胶)有过敏史的个人。完整列表,(见6 剂型、强度、成分和包装)。 • 孕妇。如果对青春期后女性进行疫苗接种,应在接种疫苗后一个月内避免怀孕(见7 警告和注意事项,7.1.1 孕妇)。 • 已观察到个体出现与妊娠期风疹相似的组织学变化,并且在孕妇接种减毒活风疹疫苗后,从蜕膜中回收了风疹病毒。因此,这些疫苗可能对胎儿构成风险。 • 对新霉素有过敏或过敏样反应的个人。每剂重组疫苗含有约 25 µg 新霉素。• 患有任何发热性呼吸道疾病或其他活动性发热性感染的个体。• 患有活动性未经治疗的结核病的个体。• 接受促肾上腺皮质激素 (ACTH)、皮质类固醇、放射、烷化剂或抗代谢物等免疫抑制治疗的个体。此禁忌症不适用于接受皮质类固醇作为替代疗法的患者,例如,用于治疗阿狄森氏病的患者。• 患有血液恶液质、白血病、任何类型的淋巴瘤或其他影响骨髓或淋巴系统的恶性肿瘤的个体。
体能训练可增强机组人员的抗 G 能力
避免因 G 导致失去意识 (GOC) 的方法是使用弹射座椅,让机组人员在高 G 暴露期间保持直立姿势。在新一代飞机(例如 F-15/18/16)问世之前,以前的飞机 G 能力不允许使用倾斜座椅。由于工程限制以及飞行员在倾斜位置的活动性和视野受限,座椅靠背角度与垂直方向的夹角被限制在大约 30 度。然而,它已经
水痘(水痘)调查指南
此版本的TB TID位专注于优先活动数字三:使用有针对性的策略来识别和治疗患有患结核病疾病风险的潜在结核病感染(LTBI)的人。为什么识别和对待LTBI的人很重要?好吧,超过80%的活动性结核病病例是与未经处理的LTBI有关的个体。找到这些患者并可能在LTBI活跃之前对其进行治疗是消除结核病的关键一步。
ERCOT月度运营概述(2024年12月)
•ERCOT正在跟踪1,917个主动生成互连请求,截至12月31日,总计379,494兆瓦。这包括154,487兆瓦的太阳能,34,450兆瓦的风,159,775兆瓦的电池和27,578兆瓦的天然气项目; 125个项目被归类为非活动性,比2024年11月的117个非活动项目。•ERCOT目前正在审查拟议的传输改进,截至2024年12月31日,总估计成本为31.5亿美元。