XiaoMi-AI文件搜索系统
World File Search System基于 RNP 的原代 CD4+T 细胞编辑...
电穿孔后 72 小时,可使用 BioLegend APC 抗人 TCR α / β 抗体通过流式细胞术评估用靶向 Edit-R sgRNA RNP 的 TRAC 或 TRBC 编辑的原代 CD4 + T 细胞的 TCR α / β 敲除情况。除了通过流式细胞术读取表型外,在基于 RNP 的编辑后 48-72 小时内,可以通过 T7EI/TIDE 测量插入/缺失形成。使用表 1 中列出的每个经过验证的 sgRNA 的引物,遵循 Dharmacon™ Edit-R™ 合成 gRNA 阳性对照试剂盒方案中的直接细胞裂解和 PCR 条件。要测量 T7EI 内切酶的插入/缺失形成,请完成上面列出的方案并使用分析软件。要通过分解 (TIDE) 分析跟踪插入/缺失来测量插入/缺失形成,请将得到的 PCR 扩增子发送至 Sanger 测序并使用网络工具,例如 http://shinyapps.datacurators.nl/tide/ 。以下方案描述了用于通过流式细胞术评估原代 CD4 + T 细胞中 TCR α / β 表型敲除的染色条件。1. 通过离心(300-5 分钟)沉淀用 PPIB、NTC2、TRAC 或 TRBC 靶向 RNP 电穿孔的 CD4 + T 细胞
新的IFRB教师聚光灯-Tamu动物科学
*DR。 CamiloHernández-Avilés是大型动物临床科学系,德克萨斯州A&M大学的资深医学和生物医学科学学院的马科治疗学专业的新助理专业。Hernandez博士在哥伦比亚的波哥大DC(南美)出生和长大。 他于2018年在哥伦比亚大学(哥伦比亚国家大学)获得兽医医学博士学位。 在兽医学校时,Hernandez博士曾是副业生物技术实验室的一名本科研究助理,他在那里,在那里他设计和进行了各种研究项目,重点介绍了基于荧光技术的验证基于荧光技术的验证,用于基于基于荧光的技术,以在基于基于荧光的技术中,以在耐药型中进行精华质量分析。 此外,他进行了两项研究,重点介绍了哥伦比亚paso fino种马和工作犬的精子冷冻保存方案的标准化。 从2017年到2018年,他是德克萨斯A&M大学种马繁殖研究实验室的来访学者。 在这段时间里,他进行了各种研究,重点是精液扩展组合物(即抗生素,能量底物)对较酷储存的马匹精子质量的影响,并验证了基于流式细胞米的基于流式细胞米的测定,以分析Stallion Semen中氧气分析。 从兽医学校毕业后,他和他的妻子(马兽医)开始了一种卧床惯例,重点是为哥伦比亚祖国的Paso Fino Stud Farms生殖服务。 进行博士学位研究时,Hernandez博士也完成了临床居留权Hernandez博士在哥伦比亚的波哥大DC(南美)出生和长大。他于2018年在哥伦比亚大学(哥伦比亚国家大学)获得兽医医学博士学位。在兽医学校时,Hernandez博士曾是副业生物技术实验室的一名本科研究助理,他在那里,在那里他设计和进行了各种研究项目,重点介绍了基于荧光技术的验证基于荧光技术的验证,用于基于基于荧光的技术,以在基于基于荧光的技术中,以在耐药型中进行精华质量分析。此外,他进行了两项研究,重点介绍了哥伦比亚paso fino种马和工作犬的精子冷冻保存方案的标准化。从2017年到2018年,他是德克萨斯A&M大学种马繁殖研究实验室的来访学者。 在这段时间里,他进行了各种研究,重点是精液扩展组合物(即抗生素,能量底物)对较酷储存的马匹精子质量的影响,并验证了基于流式细胞米的基于流式细胞米的测定,以分析Stallion Semen中氧气分析。 从兽医学校毕业后,他和他的妻子(马兽医)开始了一种卧床惯例,重点是为哥伦比亚祖国的Paso Fino Stud Farms生殖服务。 进行博士学位研究时,Hernandez博士也完成了临床居留权从2017年到2018年,他是德克萨斯A&M大学种马繁殖研究实验室的来访学者。在这段时间里,他进行了各种研究,重点是精液扩展组合物(即抗生素,能量底物)对较酷储存的马匹精子质量的影响,并验证了基于流式细胞米的基于流式细胞米的测定,以分析Stallion Semen中氧气分析。从兽医学校毕业后,他和他的妻子(马兽医)开始了一种卧床惯例,重点是为哥伦比亚祖国的Paso Fino Stud Farms生殖服务。进行博士学位研究时,Hernandez博士也完成了临床居留权德克萨斯农工大学(2019-2022)Hernandez博士的生物医学科学博士学位,重点介绍了种马精子中的临床和分子研究。他的研究表明,在纯种(TB)种马中,Acrosos功能障碍的临床表征,在种马精子中对两种基于流式细胞术的基于流式细胞术的测定的验证以及基于质量光谱的基于质量光谱的技术在基于质谱的技术中的应用来鉴定与型质体exocosal exocoltions Indrobrbrobrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrobrbrbrobrbrbrobrbrobrbrobrbrows ins的应用。
用于评估 PD-1 受体占有率的高通量流式细胞术检测:配备高通量采样器 (HTS) 选项的 BD FACSCelesta™ 流式细胞仪的药物发现应用
PMBCs 用 10 µg/mL 固定化 BD Pharmingen™ 纯化 NA/LE 小鼠抗人 CD3 刺激过夜或单独在培养基中培养(未刺激细胞)。未刺激和抗 CD3 刺激的细胞与 BD Pharmingen™ 人 BD Fc Block™ 预孵育,并用 BD Horizon™ BV421 抗人 CD3、BD Horizon™ BUV395 抗人 CD4 和连续两倍稀释液(范围从 0.15 µg/mL 到 10 µg/mL)的 BD Pharmingen™ PE 小鼠抗人 CD279 (PD-1)、克隆 EH12.1 (PE-EH12.1) 染色。结果:A. 来自一位供体的代表性数据显示淋巴细胞上 PD-1 和 CD3 的表达(使用前向和侧向散射进行门控,未显示)。 B. 条形图表示来自六名供体的样本中 CD4⁺(橙色)和 CD8⁺(蓝色)T 细胞亚群中 PD-1⁺ T 细胞的百分比,这些样本用抗 CD3 刺激或未刺激。C. 滴定曲线显示 PE-EH12.1(1.25 µg/mL)的最佳浓度在不同培养条件下对 CD4⁺ 和 CD8⁺ T 细胞亚群产生最高的染色指数。总体而言,结果表明抗 CD3 刺激增加了 CD4⁺ T 和 CD8⁺ T 细胞亚群中表达 PD-1 的 T 细胞百分比,且 CD8⁺ T 细胞上的 PD-1 表达更高。
了解 HLA 杂合性缺失以增强造血细胞移植后的治疗决策
流式细胞术在根据与正常造血骨髓群的差异识别异常群或微小残留病 (MRD) 方面发挥着至关重要的作用。异常群是通过细胞表面标志物 (CD 抗原) 的表达和抗原表达强度来识别的。Hematologics 的 ΔN:™(与正常的差异)流式细胞术侧重于表达强度而不是细胞频率来确定残留病。对于被视为异常的群,它必须是至少 40 个细胞或足够样本的 0.02% 的簇,并且异常与正常群至少有两个标准差。一旦根据 ΔN 确定细胞群为正常,就会利用免疫表型对母细胞进行分类。然后,这些分选细胞的 DNA 被发送到 Versiti 进行进一步的基因组分析。
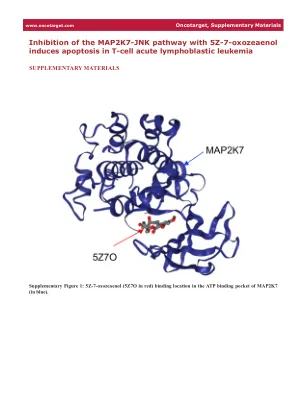
使用 5Z-7- 抑制 MAP2K7-JNK 通路...
补充图 4:用 0.45 μM(JURKAT)和 0.72 μM(P12-ICHIKAWA)5Z7O 孵育 48 小时的 JURKAT 和 P12-ICHIWAKA 细胞的 DNA 含量分析。碘化丙啶 (PI) 染色的流式细胞术分析。
利用基因组编辑“非靶向”自身抗体,一项概念验证研究
图 2. B12L 的抗 AChR 反应性和 3H9 抗体的抗 DNA 反应性。(AE)HEK293T 细胞转染了编码小鼠烟碱 AChR 五亚基的两个质粒以及 Rapsyn(HEK293T-mAChR 细胞)。(A)流式细胞术分析显示,约 30% 的细胞表达质粒 1(mTagBFP)和质粒 2(iRFP670)的报告基因。(BD)HEK293T-mAChR 细胞(B 和 D)和 WT HEK293T 细胞(C)被用作间接免疫荧光 (IIF) 的底物,以 B12L 抗体产生细胞的上清液作为主要探针。通过流式细胞术 (BC) 或显微镜 (D) 分析细胞。 (D) 中的箭头表示 AChR 簇,由重组 B12L 加与 FITC 偶联的抗人 IgG 标记(绿色)。(E) 用流式细胞术分析 6 个上清液批次中 B12L 上清液标记的 HEK293T-mAChR 或野生型细胞的比例。(F、G、H、J) 通过 ELISA (F) 或 HEp-2 免疫荧光测定 (HEp-2 IFA) (GI) 测试 3H9 抗体产生细胞 (n=6) 或野生型 (WT) 细胞的上清液的抗 dsDNA 反应性。(G) 3H9 重组抗体在 HEp-2 IFA 中呈现均质核模式,(I) 类似于具有抗 DNA 自身抗体的人血清。(J) 平均 HEp-2 IFA 滴度为 1/40。误差线 = SD
使用 CRISPR 试剂对人类 B 细胞系进行电穿孔
图 1. 最佳条件基于细胞存活率和靶向敲除率。根据上述方案,每次电穿孔用含有靶向人 CD19 的 crRNA 的 RNP(从针对不同 B 细胞系中细胞内和细胞外标志物的 30 多种 crRNA 筛选中选择)转染 100 万个 Ramos 细胞。(A)电穿孔后的第二天,用 2.5 μg/mL 碘化丙啶(BioLegend,产品目录号 421301)对部分细胞染色,并通过流式细胞术进行分析。(B)电穿孔五天后,用 2.5 μg/mL Alexa Fluor ® 647 抗人 CD19(BioLegend,产品目录号 302220,克隆 HIB19)加碘化丙啶对部分细胞染色,并通过流式细胞术进行分析。对照 = 未经电穿孔的细胞:RNP 混合物。数据由德国弗莱堡大学的 Marco Cavallari 博士提供。
Cas9+ 条件性永生化中性粒细胞祖细胞作为全基因组 CRISPR 筛选中性粒细胞分化和功能的工具
图1. 分化后的Cas9+ER-Hoxb8分化中性粒细胞与原代中性粒细胞十分相似。(A)流式细胞术分析分化0、3、4天的Cas9+ER-Hoxb8细胞。(B)在有和没有G-CSF的情况下,分化4天后CD11b和Ly6G染色的流式细胞术分析。(C、D)分化前(C)(D)和分化4天后的Cas9+ER-Hoxb8的TEM。(E)分化2天后Cas9+ER-Hoxb8的基因表达谱与Immunology Genomes数据库中的RNAseq数据进行比较。Y轴表示不同细胞类型的log2(基因表达值/所有基因的平均表达值);从左到右依次为:巨噬细胞(MF_PC、MF_Fem_PC、MF_226+II+480lo_PC、MF_RP_Sp、MF_Alv_Lu、MF_pIC_Alc_Lu、MF_microglia_CNS、MF_AT)、单核细胞(Mo_6C+II-_Bl、Mo_6C-II-)、中性粒细胞(GN_BM、GN_Sp、GN_Thio_PC)和肥大细胞(MC_heparainase_PC)。所有数据代表至少 2 次实验。
使用 CRISPR-dCas9-dnmt3a 系统进行 hTERT 基因修饰作为治疗胶质瘤的方法
背景:据报道,各种疾病(包括不同的癌症)中都存在异常的 DNA 甲基化模式。CRISPR/Cas9 是一种低成本、高效的基因编辑工具,最近彻底改变了生物技术。研究表明,CRISPR/Cas9 系统可以有效地靶向和纠正甲基化。目的:端粒酶对癌细胞的生存起着重要作用。它由 hTERT 基因编码。本研究评估了 CRISPR/Cas9 靶向 hTERT 治疗胶质瘤癌细胞的有效性。方法:使用携带 sgRNA 和 Cas9 杂交体的 EF1a-hsaCas9-U6-gRNA 载体转染 U87 胶质瘤细胞。研究了 4 和 8 µ g/mL 聚凝胺浓度以提高转染效率。使用实时 PCR 评估经过亚硫酸氢盐修饰的 hTERT 的表达水平。还使用流式细胞术和蛋白质印迹法来确定细胞中是否存在端粒酶。采用高分辨率熔解分析(HRM)检测hTERT启动子的甲基化情况,流式细胞术检测转染U87细胞凋亡率。结果:结果表明,gRNA显著提高了转染效果,4µg/mL聚凝胺和80µg/mL转染后,U87细胞中hTERT的表达与未转染gRNA和基底细胞相比有显著差异,流式细胞术显示转染细胞中hTERT水平降低,转染gRNA后U87细胞凋亡率高于未转染gRNA组。结论:设计的CRISPR/Cas9系统可以降低hTERT表达和端粒酶活性,从而抑制神经胶质瘤细胞生长。