XiaoMi-AI文件搜索系统
World File Search System会员简报 - 俄亥俄州立法服务委员会
目前,联邦食品药物管理局(FDA)批准了三种药物治疗阿片类药物依赖性:美沙酮,丁丙诺啡和纳曲酮。如下表所示,区分它们的一种方法是它们是激动剂还是对手。激动剂是一种激活大脑中某些受体的药物。全部激动剂阿片类药物激活大脑中的阿片类药物受体,从而产生完整的阿片类药物作用。全部激动剂的例子是海洛因,羟考酮,氢可酮和吗啡,以及MAT药物美沙酮。部分激动剂阿片类药物激活大脑中的阿片类药物受体,但程度要比完整的激动剂少得多。丁丙诺啡是部分激动剂的一个例子。拮抗剂是一种药物,可通过连接到阿片受体而不激活它们来阻断阿片类药物。拮抗剂不会引起阿片类药物作用,并且阻止了全部激动剂阿片类药物。例子是纳曲酮和纳洛酮。5
三唑187是一种有偏见的kor激动剂,可以抑制瘙痒而无需镇静和
(未通过同行评审认证)是作者/资助者。保留所有权利。未经许可就不允许重复使用。此预印本版的版权持有人于2025年2月23日发布。 https://doi.org/10.1101/2025.02.17.638680 doi:biorxiv preprint
5-HT4R激动剂通过单侧6-OHDA病变的小鼠降低L-DOPA诱导的运动障碍
帕金森氏病是由黑质Nigra Pars Compacta的多巴胺能神经元的选择性脆弱性和细胞丧失引起的,因此,纹状体多巴胺消耗。在帕金森疾病疗法中,多巴胺的损失是由L-DOPA的给药来抵消的,L-DOPA最初在改善运动节目Symp TOMS方面有效,但随着时间的流逝,L-DOPA诱发的疾病诱发了不可控制的疾病运动的负担。迄今为止,没有有效的运动障碍治疗。多巴胺能和5-羟色胺能系统与内在联系在一起,近年来,在L-多巴巴诱导的发育不良中,已经确立了突触前5-HT1A/B受体的作用。我们假设后突触后的5-羟色胺受体可能发挥作用,并涉及5-HT4受体对运动症状和L-DOPA诱导的运动障碍的调节对帕金森氏病的单侧6-OHDA小鼠模型中的l-dopa诱导的运动障碍。给药67333卢比,一种5-HT4受体部分激动剂,可降低L-DOPA诱导的运动障碍,而不会改变L-Dopa的促动力效应。在背外侧纹状体中,我们发现5-HT4受体主要表达在含D2R的培养基神经元中,并且其表达通过多巴胺消耗和L-DOPA治疗改变。我们进一步表明,5-HT4受体激动剂不仅降低了L-DOPA诱导的运动障碍,而且还可以增强纹状体合理培养基中棘神经元中CAMP-PKA途径的激活。综上所述,我们的发现表明,后突触后5-羟色胺受体5-HT4的激动剂可能是减少L-DOPA诱导的运动障碍的一种新型治疗方法。
新西兰数据表1产品名称
阿片类药物作为激动剂,拮抗剂或阿片受体的部分激动剂[13]。 阿片类动力学家与G蛋白偶联受体结合,引起细胞超极化。 最相关的阿片类镇痛药以激动剂方式与中央和周围神经系统中的MOP受体结合,以引起镇痛。 mop激活抑制了上升疼痛途径,包括穿过脊髓,脑干,丘脑和皮质的神经元[14]。 阿片类拖把激动剂还激活涉及脑干的抑制性下降疼痛途径。 外周科受体受体也可能在组织损伤和炎症部位介导镇痛。 拮抗剂与受体结合,但没有产生功能反应,同时阻止激动剂与该受体结合(纳洛酮)[13]。 部分激动剂与受体结合,但无论服用多少药物(丁丙诺啡),都只会引起部分功能反应。阿片类药物作为激动剂,拮抗剂或阿片受体的部分激动剂[13]。阿片类动力学家与G蛋白偶联受体结合,引起细胞超极化。最相关的阿片类镇痛药以激动剂方式与中央和周围神经系统中的MOP受体结合,以引起镇痛。mop激活抑制了上升疼痛途径,包括穿过脊髓,脑干,丘脑和皮质的神经元[14]。阿片类拖把激动剂还激活涉及脑干的抑制性下降疼痛途径。外周科受体受体也可能在组织损伤和炎症部位介导镇痛。拮抗剂与受体结合,但没有产生功能反应,同时阻止激动剂与该受体结合(纳洛酮)[13]。部分激动剂与受体结合,但无论服用多少药物(丁丙诺啡),都只会引起部分功能反应。
糖尿病 - 胰高血糖素样肽-1 激动剂药物数量管理政策 - 按天索赔
本政策未包括经 FDA 批准用于慢性体重管理的 GLP-1 和 GLP-1/GIP 激动剂产品。请参阅附录 A,了解每日索取限额中涉及的 GLP-1 激动剂和 GLP-1/GIP 激动剂列表。政策声明本药品数量管理计划旨在促进 GLP-1 激动剂和 GLP-1/GIP 激动剂的安全、有效和经济使用。下面概述的每日索取数量限制可以单独应用,也可以与每种药物的标准每日限制结合使用。有关每种产品每日数量限制的详细信息,请参阅各自的每日药品数量管理政策。所有批准均在以下期限内提供。每日索取数量限制
使用二氧化硅纳米颗粒的大小激动剂和结核病抗原促进Th17的极化免疫力
摘要:有效驱动Th17固定的免疫反应的佐剂和免疫调节剂不是标准疫苗工具包的一部分。抗疫苗佐剂和递送技术迫切需要TH17或TH1/17免疫和保护细菌病原体,例如结核病(TB)。TH17极化的免疫反应可以使用结合和激活C型凝集素受体(CLR)的激动剂,例如巨噬细胞诱导的C型凝集素(Mincle)。使用可调的二氧化硅纳米颗粒(SNP)制定了与重组结核分枝杆菌融合抗原M72相结合的小杆菌激动剂(SNP)。阴离子裸子SNP,疏水苯基官能化SNP(P-SNP)和阳离子胺功能官能化的SNP(A-SNP)与三个合成的Mincle Anmeant,UM-1024,UM-1052,UM-1052和UM-1098和UM-1098和IM-1098涂有不同尺寸的不同尺寸,并在体内和Vivo中进行了评估。通过静电和疏水相互作用将抗原和佐剂共掺入SNP上,从而促进了多价显示并传递到抗原呈递细胞。阳离子A-SNP对抗原和辅助的效率最高。此外,UM-1098吸附的A-SNP配方在体外表现出缓慢释放的动力学,在12个月的存储中出色的稳定性以及人类外周血单核细胞的强大IL-6诱导。在A-SNP上对UM-1098和M72的共吸附可显着改善BALB/C小鼠的体内抗原特异性体液和Th17极化免疫反应,相对于对照组。综上所述,A-SNP是一个有前途的平台,用于辅助和适当呈现佐剂和抗原,并为它们作为针对结核病或其他TH17免疫有助于保护的TB或其他疾病的疫苗输送平台的进一步发展提供了基础。关键字:Mincle激动剂,CLR佐剂,结核病疫苗,二氧化硅纳米颗粒,Codelivery,Th17,M72,UM-1098
双特异性抗体重定向合成激动剂受体改性T细胞针对黑色素瘤
背景肉瘤是间充质细胞起源的一个异源性群体,通常很难以较差的预后治疗。大约30%的肉瘤的特征是表达充当致癌驱动因素的融合蛋白。脱落的小圆形细胞肿瘤(DSRCT)是由病原体EWSR1-WT1融合事件定义的典型融合驱动的肉瘤。所得的EWSR1-WT1致癌融合蛋白包含与正常自我蛋白不同的共有氨基酸序列。我们假设克隆保守的融合蛋白可能会产生共享或公共新抗原(NeoAgs)的免疫原性子集(NEOAGS),这可能是新型免疫治疗方法的靶标。使用HLA免疫沉淀/质谱法(HLA-IP/MS)屏幕的方法和结果,我们确定了从EWSR1- WT1融合蛋白的Junctim中得出的9-氨基酸肽序列(SsygQQS EK),均经常出现在HLA-WT1融合蛋白中,并在HLA-a*03中均出现。结合同源肽。我们证实了相同的肽序列在生理上由HLA-A*03 + DSRCT细胞呈现。使用带有MS识别的NEOAG的荧光团偶联的HLA-Multimers(Dextramers),我们检测到在HLA + DSRCT患者子集中结合融合NEOAG的循环T细胞,确认了免疫原性。随后,我们使用融合NEOAG特异性T细胞的体外抗原指导的克隆膨胀来隔离n = 3 HLA-A*03限制性,n = 1 HLA-A*11限制性融合NeoAg反应性克隆。使用单细胞测序,我们检索了由这些T细胞表达的T细胞受体(TCR)的TCRAB基因序列,并将其克隆到逆转录病毒表达载体中。多克隆CD8 + T细胞被检索到的TCR基因结合融合融合的葡萄晶剂,而不是载有病毒肽的控制葡萄糖剂。此外,表达候选TCR的CD8 + T细胞与表达必要的HLA等位基因和EWSR1-WT1融合的细胞稳健上调TNF A,并特别裂解HLA + DSRCT细胞。有趣的是,我们确定了一个独特的TCR,该TCR以肽范围的方式结合了融合NEOAG,该方式可以特异性地裂解HLA-A*03 +和-a*11 + dsRCT细胞,但没有在HLA-A*02的上下文中使用融合NeoAg。这意味着单一的TCR治疗可能覆盖所有北美DSRCT患者的36%。结论我们的数据表明,复发性EWSR1-WT1融合的连接是自然处理的,并在DSRCT细胞普遍存在的HLA等位基因的背景下进行了预处理。这些发现确定了融合派生的公共NEOAG是融合驱动的恶性肿瘤的可行的治疗靶标的来源。这项工作为针对EWSR1-WT1和其他复发性致癌融合的新型T细胞基于T细胞的疗法的临床翻译奠定了基础。
2型糖尿病管理的演变:血糖控制及SGLT-2抑制剂和GLP-1受体激动剂
摘要:糖尿病(DM)是初级保健医师每天遇到的最普遍的疾病之一。与DM相关的并发症可能包括肾病,神经病和视网膜病变(“微血管并发症”),以及心血管疾病(CVD),其中可能包括心肌梗死(MI)和中风(“大型复杂性)”。在1990年代,具有里程碑意义的临床试验表明,密集的血糖控制可以降低发生微血管并发症的风险,但并未明确证明具有密集型血糖控制的大血管并发症的减少。在这一点上,强化血糖控制成为护理标准(SOC)。在2000年代,评估2型糖尿病患者(T2D)和确定的CVD的患者中强度血糖控制的影响或CVD的危险因素随后未能确定了一项严重的高血管造成的危险,这是因为试验的早期终止,因为终止了高血管造成的高血管造成的效果,因为这是由于终止了高血管造成的,因为这是由于终止了高血管造成的,因此由于导致的高血管造成的效果而导致,因此终止了高血管造成的效果。血糖控制。这些结果导致在老年患者(尤其是患有CVD的患者)中建议使用严格的血糖靶标。在2007年,报告浮出水面后一切都发生了变化,表明罗斯列酮与MI风险的显着增加有关,并且增加了心血管死亡的风险增加,而心血管死亡的风险显着意义。因此,通过这些试验,一些新的代理人,特别是因此,2008年,FDA规定所有新糖尿病药物必须在批准药物批准之前排除动脉粥样硬化心脏病患者(ASCVD)的不可接受的风险,从而进行了其他心血管安全试验。
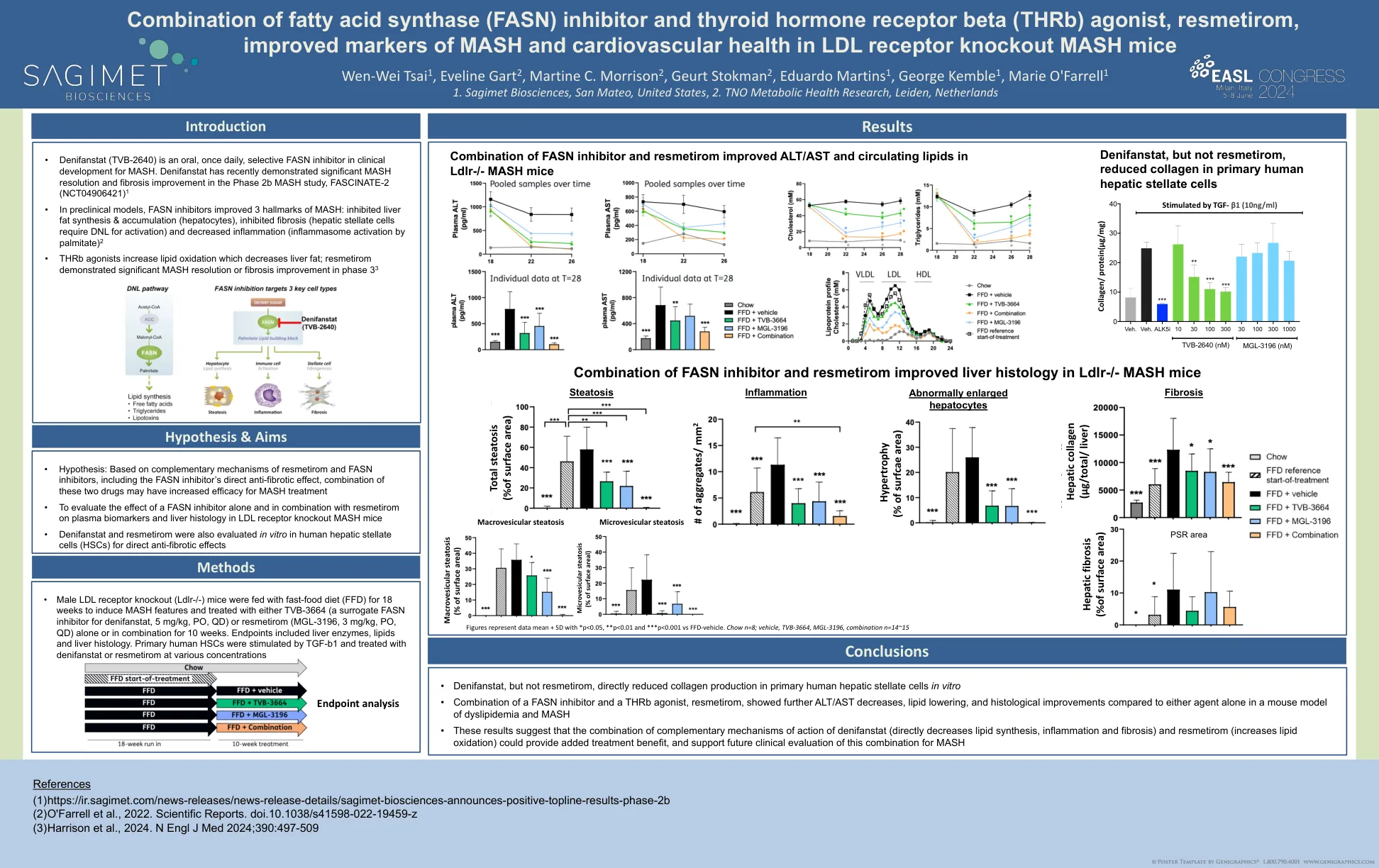
脂肪酸合酶(FASN)抑制剂和甲状腺激素受体β(THRB)激动剂的组合,
•雄性LDL受体敲除(LDLR - / - )小鼠用快餐饮食(FFD)喂养18周,以诱导MASH特征,并用TVB-3664(替代FASN抑制剂denifanstat,5 mg/kg,PO,PO,pO,QD)或RESMETMETIROM(MGL-316,MGL-31,QG),QGL-31,QGL-316,QGL-31,QGL-3196,ON 3 MGL-31,ON,ON 3 MGL-316,ONS Q. 10周。终点包括肝酶,脂质和肝组织学。原代人HSC被TGF-B1刺激,并在各种浓度下用denifanstat或resmetirom处理