XiaoMi-AI文件搜索系统
World File Search System安装和激活 LuminarAI 的说明
6. 如果您在“我的软件”选项卡中没有看到 Luminar AI,则可能是您使用其他电子邮件地址购买的。如果是这种情况,请向下滚动并在“链接我的许可证”块中将您的 Luminar AI 许可证链接到您现有的 Skylum 帐户。为此,请输入您购买 Luminar AI 时使用的电子邮件地址,然后单击“链接我的许可证”。之后,请转到新电子邮件地址的收件箱并验证您的电子邮件。7. 如果您在 App Store 上购买了 Luminar AI,请单击链接向我们的支持团队提交购买证明,他们会立即为您提供帮助!
C-JUN的磷酸化状态和DNA结合活性取决于结合位点的细胞内浓度 第8卷31980核酸研究 受体结合的尿激酶与I型纤溶酶原激活剂抑制剂的可及性 胰岛素调节有丝分裂原激活的蛋白激酶激酶(MEK),有丝分裂原激活的蛋白激酶和酪蛋白激酶在细胞核中:Possibl gi-protein A大鼠大脑皮层中的亚基 协调人造血细胞中HOX基因的调节 在体内抑制tonb盒的tonb盒共识pentapeptide 中的甲基定向修复框架突变 CALF的DNA依赖性RNA聚合酶的合成...
基因选择性转录因子通过与其靶基因调节区域内的特定DNA元件结合(1)。但是,并非完全定义此DNA结合的序列要求。几个参数,例如蛋白质 - 蛋白质相互作用与相邻结合的因素,DNA结构的影响(弯曲等)。),重要的是,结合位点与认知因子的比率确定给定转录因子是否可以有效地与相应的结合位点相互作用。体外和大概也在体内也是如此,对于确定转录因子是否会与其最佳识别序列的变体结合,因此,它的基因调节。在这些考虑因素中提示,我们询问是否存在一种蜂窝机制,该机制是否存在在转录因子活动和可用目标位点的繁琐之间保持平衡。对AP-1家族成员的特征良好转录因子C-Jun进行了实验(2-4)。包含AP-1结合位点的启动子是C-Jun调节的目标。C-Jun的活性受到多种机制的紧密控制,并且对蛋白质的异常调节会导致恶性转化和致癌作用(5)。在这项研究中,我们描述了一种机制,该机制通过改变其磷酸化态的DNA结合活性,取决于细胞中存在的C-Jun结合位点的浓度。这种机制可以用来设置和微调C-Jun与其结合位点的比率。有趣的是,与这种现象有关的磷酸化位点与以前据报道经历信号依赖性去磷酸化相同。
JAK2V617F可逆激活显示其必不可少的...
从http://aacrjournals.org/cancerdiscovery/article-pdf/doi/10.1158/2159-8290.cd22-22-22-0952/3404475/cd-22-22-22-0952.pdf by bern University by Bern Universiti
视觉引导手指运动时的大脑激活
通过视觉引导手部动作进行的计算机交互通常采用抽象的基于光标的反馈或不同程度真实感的虚拟手 (VH) 表示。目前尚不清楚在虚拟现实环境中更改这种视觉反馈的效果。在这项研究中,19 名健康的右撇子成年人使用四种不同类型的视觉反馈执行食指运动(“动作”)和观察运动(“观察”):简单的圆形光标 (CU)、指示手指关节位置的点光 (PL) 图案、阴影卡通手 (SH) 和逼真的 VH。使用数据手套记录手指运动,并以光学方式记录眼动追踪。我们使用功能性磁共振成像 (fMRI) 测量大脑活动。与基线相比,动作和观察条件均显示枕颞皮质中的 fMRI 信号响应更强。动作条件还会引起运动、体感、顶叶和小脑区域的双侧激活增加。对于这两种情况,带有移动手指的手部反馈(SH、VH)比 CU 或 PL 反馈导致更高的激活,特别是在早期视觉区域和枕颞皮质中。我们的结果表明,与视觉不完整的手部和抽象反馈相比,在视觉引导的手指运动过程中,皮质区域网络的募集更强。这些信息可能对研究和应用或训练相关范例中涉及人体部位的视觉引导任务的设计产生影响。
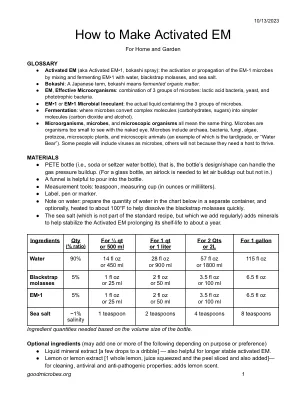
激活的EM
●激活的EM(又名激活的EM•1,Bokashi喷雾):通过将EM•1与水,Blackstrap糖蜜和海盐混合和发酵EM•EM-1微生物的激活或传播。●Bokashi:日本术语,Bokashi表示发酵有机物。●EM,有效的微生物:3组微生物的组合:乳酸菌,酵母和光营养细菌。●EM•1或EM•1个微生物接种剂:包含3组微生物的实际液体。●发酵:微生物将复杂分子(碳水化合物,糖)转化为更简单的分子(二氧化碳和酒精)。●微生物,微生物和微观生物都意味着同一件事。微生物是太小的生物,无法用肉眼看。微生物包括古细菌,细菌,真菌,藻类,原生动物,微观植物和微观动物(其中一个示例是Tardigrade或“水熊”)。有些人将包括病毒作为微生物,而另一些人则不会因为他们需要宿主来壮成长。
靶向、肿瘤外激活 - 研究合集
近年来,嵌合抗原受体 (CAR) T 细胞癌症免疫疗法在临床上取得了长足进展。然而,与安全性相关的挑战仍然存在;一个主要问题是当 CAR 触发对健康细胞上存在的抗原的反应(靶向、肿瘤外反应)时。改善这种情况的策略依赖于受体亲和力和信号传导之间的复杂关系,这样人们就可以设计出一种仅由表达高抗原水平的肿瘤细胞激活的 CAR。在这里,我们开发了一个 CAR T 细胞展示平台,该平台具有稳定的基因组表达和基于白细胞介素 2 信号传导的快速功能筛选。从对靶抗原具有高亲和力的 CAR 开始,我们结合 CRISPR-Cas9 基因组编辑和深度突变扫描来生成抗原结合域变体库。该库根据抗原结合或细胞信号传导进行了多轮选择。对所得文库进行深度测序和比较分析,发现特定变体富集和消耗,我们从中挑选出基于抗原表达水平被肿瘤细胞选择性激活的 CAR。我们的平台展示了如何结合基于功能筛选的定向进化和深度测序引导选择来提高 CAR 的选择性和安全性。
胰岛素抵抗在健康体检者血浆黄嘌呤氧化还原酶激活中的可能作用
我们之前在一项横断面研究中发现胰岛素抵抗 (IR) 与血浆黄嘌呤氧化还原酶 (XOR) 活性相关。然而,IR 是否会诱导 XOR 活性增加尚未阐明。这项回顾性纵向观察研究包括 347 名参与者(173 名男性,174 名女性),他们每年接受健康检查并且未接受过药物治疗。在基线时确定了稳态模型评估 IR (HOMA-IR) 指数以及身体和实验室测量值。在基线和 12 个月的随访检查中,使用我们基于 [ 13 C 2 , 15 N 2 ] 黄嘌呤和液相色谱/三重四极杆质谱的新型检测方法测定血浆 XOR 活性。 IR 受试者(定义为 HOMA-IR 指数 ≥ 1.7(n = 92))的血浆 XOR 活性水平显著(p < 0.001)高于无 IR 的受试者(n = 255),12 个月后,180 人(51.9%)的血浆 XOR 活性增加。多变量线性和逻辑回归分析表明,基线时的 IR(而不是 BMI 或腰围)与血浆 XOR 活性显著相关(β = 0.094,p = 0.033),并且经过调整各种临床参数(包括基线时的血浆 XOR 活性)后,12 个月期间血浆 XOR 活性增加(比值比,1.986;95% 置信区间,1.048–3.761;p = 0.035)。这些结果表明,IR 以与肥胖无关的方式诱导血浆 XOR 活性增加。
垂体腺苷酸环化酶激活型过肽是有效的
1在体内研究了垂体腺苷酸环化酶激活多肽(PACAP)对微血管血流和血浆蛋白泄漏的影响。2对PACAP38(肽的38个氨基酸形式)的皮内注射,导致通过'33xe清除技术测得的血流剂量依赖性增加。每个位点PACAP38的10-2 mol诱导血流的同等增加,每个部位的人轴 - 钙蛋白基因相关肽(CGRP)和每个位点每个位点的血管活性肠肠多肽(VIP)的摩尔(VIP)10-2 mol诱导。3 PACAP38的血管扩张活性与用激光多普勒流量计测量的肽PACAP27的27个氨基酸形式无显着差异,而在每个位点10-2摩尔以上10-2摩尔以上的基础流量以上,导致104±14%,导致110±18%。4在每个位置1012 mol时,PACAP38的效果比CGRP的效果更长。在2小时,PACAP38(p <0.05)时,血流量保持在对照中的显着增加(p <0.05),而在此时,皮内CGRP后的血流恢复为对照值。5 PACAP38仅注射了对“ 25i标记白蛋白的微血管泄漏”。然而,PACAP38显着增强了缓激肽诱导的水肿,其中它比VIP高约100倍。6 divap38诱导的水肿增强并未被吲哚美辛抑制,该剂量确实抑制了蛛网膜酸抑制铁丁蛋白诱导的水肿的增强。7 PACAP38至少与其他假定在体内兔皮肤测试时所涉及的其他肽一样有效。PACAP可能有助于炎症的高度和水肿成分。关键字:垂体腺苷酸环化酶激活多肽;血管舒张;动脉;血管活性肠多肽; Cal- citonin基因相关肽;腺苷酸环化酶
毒蕈碱M1和M4受体激活剂的潜力...
认知障碍是精神分裂症的核心症状,也是长期功能效果不佳的主要决定因素。尽管做出了巨大的努力,但我们尚未对与精神分裂症(CIAS)相关的认知障碍进行任何认可的药理治疗。在临床前研究和最近的临床试验中的进步结合,导致对精神分裂症中新型毒蕈碱乙酰胆碱受体(MACHR)激动剂的认知增强潜力的兴趣兴起。本文概述了针对M 1和M 4 MACHR的科学原理。我们描述了这些受体的神经科学研究的演变,因为早期的药物发现工作集中于MACHR激动剂Xanomeline。这项工作表明,M 1和M 4 MACHR在与认知有关的大脑区域中高度表达。通过使用神经元和非神经元机制利用选择性受体亚型化合物,在动物模型中,M 1和M 4 MACHR的功能显性已在动物模型中得到了广泛的特征。双M 1 /m 4 MACHR激动剂的最新临床试验显示出有希望的,可复制的证据,证明了精神分裂症潜在的亲认知作用,而其他几种MACHR激动剂在临床发展中。
靶向组蛋白去乙酰化酶增强Erastin诱导的铁死亡对EGFR激活突变肺腺癌的治疗效果
肺癌是死亡率最高的恶性肿瘤,而肺腺癌(LUAD)占所有肺癌的40%(1)。在亚洲,表皮生长因子受体(EGFR)是LUAD最常见的驱动突变,发生率为55%(2-4),其中EGFR激活突变在全球占17.4%,在中国占37.3%(5)。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)目前是EGFR突变LUAD患者的标准一线治疗方案(6)。尽管使用EGFR-TKI已为晚期EGFR突变型NSCLC患者带来显著的临床获益和前所未有的生存率提高(7-10),但不可避免地会产生获得性耐药。继发性EGFR突变,包括EGFR-T790M突变和EGFR结构域内的其他突变、MAPK、PI3K和细胞周期基因的突变以及EGFR或其他致癌基因如MET的扩增,导致LUAD细胞获得性EGFR-TKI耐药(11-13)。但有些患者在缺乏已知耐药机制的情况下获得了EGFR-TKI耐药。因此,内在性EGFR-TKI耐药是临床上的一个挑战。据报道,大约20%-30%的EGFR突变型LUAD对EGFR-TKI具有内在性耐药(14)。因此,如何克服这些获得性和内在性的EGFR-TKI耐药一直是临床关注的焦点。