XiaoMi-AI文件搜索系统
World File Search System酪氨酸激酶抑制剂在治疗中的应用......
因此有必要采用更有效的替代方案。酪氨酸激酶抑制剂,例如伊马替尼,负责抑制 BCR-ABL 蛋白,有望为患者提供更好的生活质量。本综述旨在汇编和讨论 CML 治疗的重要性,重点关注现有治疗方法的发展。该方法包括使用 SCIELO、ScienceDirect 和 Google Scholar 数据库进行文献目录审查,以涉及 CML 特征和药物疗法的著作作为纳入标准。酪氨酸激酶抑制剂(如伊马替尼)的问世彻底改变了慢性粒细胞白血病的治疗,伊马替尼可抑制 BCR-ABL 蛋白,从而提高患者的生活质量。然而,在酪氨酸激酶抑制剂问世之前,人们一直使用其他药物,如白消安、羟基脲和干扰素 α,这些药物疗效较差,死亡率较高。 CML 治疗的进展代表了肿瘤学的一个里程碑,凸显了针对性和个性化治疗的必要性。通过这种方式,
Janus激酶(JAK)抑制剂是什么?
疫苗是保护儿童免受感染的有效方法。有不同类型的疫苗。大多数疫苗不含任何活感染。服用JAK抑制剂时,这些非活疫苗是安全的。一些非活疫苗的例子包括破伤风疫苗和流感疫苗。
使用 DNA 编码化学技术鉴定有效的泛 Ephrin 受体激酶抑制剂
EPH 受体 (EPHs) 是酪氨酸激酶的最大家族,在与 Ephrin 细胞表面相关配体结合后磷酸化下游底物。在来自子宫内膜异位症患者的大量子宫内膜异位病变中,我们发现子宫内膜异位病变中的 EPHA2 和 EPHA4 表达相对于正常的正常子宫内膜有所增加。由于通过 EPHs 的信号传导与细胞迁移和侵袭增加有关,我们假设化学抑制 EPHA2/4 可能具有治疗价值。我们筛选了 DNA 编码化学库 (DECL) 以快速识别 EPHA2/4 激酶抑制剂。命中化合物 CDD - 2693 对 EPHA2 (K i : 4.0 nM) 和 EPHA4 (K i : 0.81 nM) 表现出皮摩尔/纳摩尔激酶活性。激酶组分析显示,CDD-2693 与大多数 EPH 家族和 SRC 家族激酶结合。使用 NanoBRET 靶标参与分析,CDD-2693 对 EPHA2 (IC 50 : 461 nM) 和 EPHA4 (IC 50 : 40 nM) 具有纳摩尔活性,但对 SRC、YES 和 FGR 具有微摩尔抑制剂活性。化学优化产生了 CDD-3167,对 EPHA2 (K i : 0.13 nM) 和 EPHA4 (K i : 0.38 nM) 具有皮摩尔生化活性,对 EPHA2 (IC 50 : 8.0 nM) 和 EPHA4 (IC 50 : 2.3 nM) 具有出色的细胞效力。此外,CDD-3167 保持了卓越的脱靶细胞选择性。在 12Z 子宫内膜异位上皮细胞中,CDD - 2693 和 CDD - 3167 显著降低了 EFNA5(配体)诱导的 EPHA2/4 磷酸化,降低了 12Z 细胞活力,并降低了 IL - 1 β 介导的前列腺素合酶 2 ( PTGS2 ) 表达。CDD - 2693 和 CDD - 3167 降低了子宫内膜异位症患者原发性子宫内膜上皮类器官的扩增,并降低了尤文氏肉瘤的活力。因此,使用 DECL,我们确定了有效的泛 EPH 抑制剂,这些抑制剂在子宫内膜异位症和癌症的细胞模型中表现出特异性和活性。
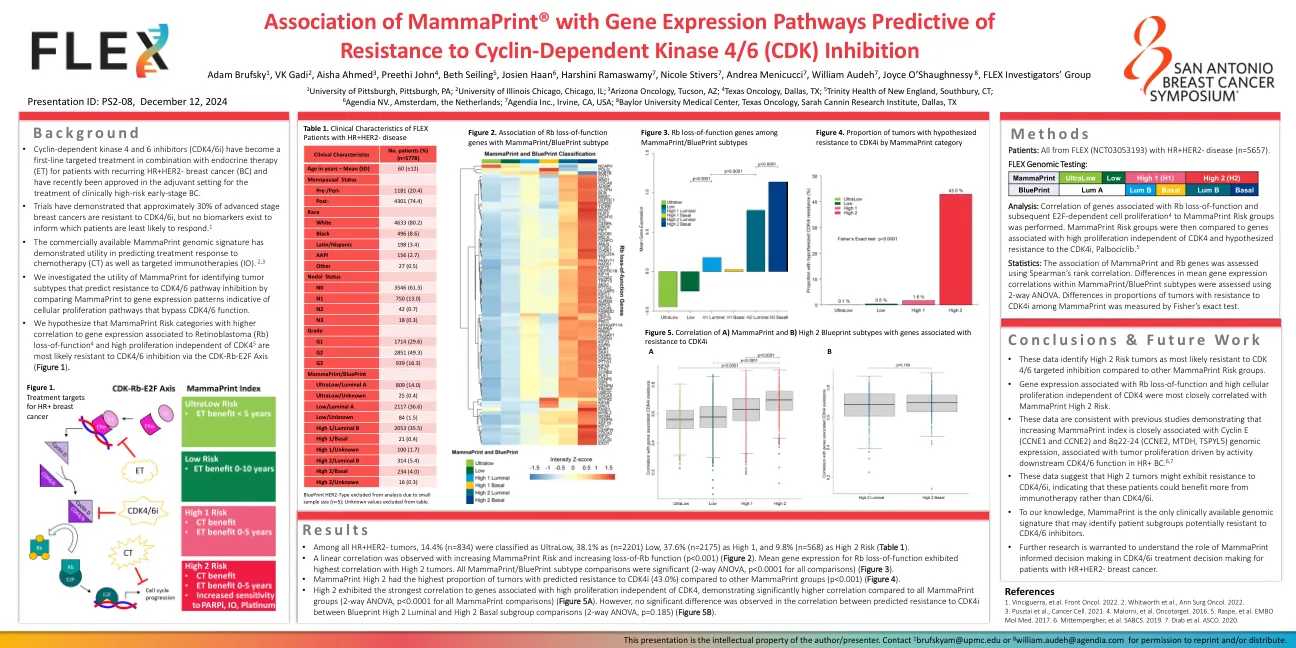
Mammaprint®与基因表达途径的关联预测对细胞周期蛋白依赖性激酶4/6(CDK)抑制的抗性
•在所有HR+HER2-肿瘤中,14.4%(n = 834)被归类为Ultralow,38.1%为(n = 2201)低,37.6%(n = 2175)为高1,而9.8%(n = 568)为高2风险(表1)。•观察到线性相关性,随着哺乳动物的风险增加和RB功能的增加(p <0.001)(图2)。RB功能丧失的平均基因表达与高2个肿瘤表现出最高的相关性。所有哺乳动物/蓝图亚型比较都是显着的(所有比较的2路ANOVA,p <0.0001)(图3)。•与其他哺乳动物组相比,乳腺斑点高2的肿瘤比例最高,对CDK4I的耐药性(43.0%)(p <0.001)(图4)。•高2显示与与CDK4无关的高增殖相关的基因最强的相关性,与所有哺乳动物基团相比,相关性明显更高(所有乳突比较的2条ANOVA,P <0.0001)(图5A)。然而,在蓝图高2个腔与高2基底亚组比较之间对CDK4I的抗性之间的相关性中没有显着差异(2路ANOVA,P = 0.185)(图5B)。
关于使用细胞周期蛋白依赖性激酶 (CDK) 4/6 抑制剂治疗激素受体阳性 (HR+ve)、Her2ve E 的共识指南
1 印度拉贾斯坦邦斋浦尔圣雄甘地医科大学 Sri Ram 癌症中心临床血液学系 2 印度新德里希望肿瘤中心肿瘤内科系 3 印度古吉拉特邦艾哈迈达巴德古吉拉特邦癌症研究所肿瘤内科系 4 印度北方邦瓦拉纳西塔塔纪念中心 Mahamana Pandit Madan Mohan Malviya 癌症中心和 Homi Bhabha 癌症医院肿瘤内科系 5 印度中央邦博帕尔 Silverline 医院肿瘤内科系 6 印度特伦甘纳邦海得拉巴 Basavatarakam 印度美国癌症医院肿瘤内科系 7 印度卡纳塔克邦班加罗尔圣约翰医学院及医院肿瘤内科系 8 印度特伦甘纳邦海得拉巴 AIG 医院肿瘤内科系 9肿瘤科,Sparsh Hospitals and Critical Care Pvt Ltd.,布巴内斯瓦尔,奥里萨邦,印度 10 肿瘤内科,Fortis Medical,古尔冈,哈里亚纳邦,印度
抑制 CDK8/19 介导激酶可防止对 EGFR 靶向药物产生耐药性
摘要:耐药性是实现常规和靶向抗癌药物治愈的主要障碍。获得性耐药性的出现最初是由非遗传转录变化介导的,这种变化发生的频率比突变高得多,可能涉及群体规模的转录组适应。CDK8/19 激酶通过与转录介导复合物结合,与不同的信号响应转录因子协同调节转录重编程。在这里,我们测试了 CDK8/19 抑制是否可以阻止对作用于表皮生长因子受体 (EGFR/ERBB1/HER1) 的药物的适应。在 BT474 和 SKBR3 乳腺癌细胞长期暴露于 EGFR 靶向小分子 (吉菲替尼、厄洛替尼) 以及 SW48 结肠癌细胞长期暴露于抗 EGFR 单克隆抗体西妥昔单抗后,分析了耐药性的发展。在所有情况下,用单剂量药物治疗小细胞群(~10 5 个细胞)最初会导致生长抑制,随后适应群体中增殖恢复并产生耐药性。然而,这种适应总是通过添加选择性 CDK8/19 抑制剂来阻止,即使此类抑制剂单独对细胞生长只有中等或没有影响。这些结果表明,将 EGFR 靶向药物与 CDK8/19 抑制剂相结合可能会延迟或阻止肿瘤对治疗产生耐药性。
● Nuvisertib (TP-3654) 是一种口服高选择性 PIM1 激酶抑制剂,
马萨诸塞州马尔伯勒,2024 年 11 月 6 日 — 住友制药美国公司 (SMPA) 今天宣布,将在 2024 年 12 月 7 日至 10 日于加利福尼亚州圣地亚哥举行的第 66 届美国血液学会 (ASH) 年会暨博览会上发表三篇演讲。演讲将包括支持 nuvisertib 的新临床数据,nuvisertib 是一种正在研究用于治疗复发/难治性骨髓纤维化 (MF) 的试验性小分子,以及 enzomenib,一种正在研究用于治疗复发/难治性急性白血病的试验性口服小分子。正在进行的 nuvisertib 1/2 期研究的结果继续支持 nuvisertib 单药治疗耐受性良好,没有剂量限制性毒性 (DLT) 并且早期临床活动前景光明。目前,这项全球研究正在扩大,以评估 nuvisertib 与 JAK 抑制剂芦可替尼(首个获批的 JAK 抑制剂)和 momelotinib(最近获批用于治疗贫血症 MF 患者的 JAK 抑制剂)的联合使用,以评估安全性和临床活性。此外,来自 enzomenib 1/2 期研究的新临床数据显示,在广泛治疗剂量范围内的患者中,该疗法均表现出有希望的临床活性,并且安全性数据令人鼓舞,因为 enzomenib 耐受性良好,未观察到 DLT 或因与 enzomenib 相关的不良事件而停药的案例。SMPA 肿瘤科首席医疗官 Jatin Shah 医学博士表示:“对于复发性 AML 或骨髓纤维化患者,迫切需要新的有效治疗方案,以显著改善这些癌症相关的不良预后。这些数据让我们备受鼓舞,我们将继续快速推进复发/难治性 MF 和急性白血病的开发项目。” “我们期待在 12 月即将召开的会议上分享最新结果,这进一步支持 nuvisertib 和 enzomenib 的开发,并将继续致力于推进我们产品线中的新发展。”
OMX-0407 是一种光谱选择性激酶抑制剂,表现出...
OMX-0407 是一种口服的光谱选择性激酶抑制剂,靶向关键的肿瘤相关酪氨酸激酶和盐诱导激酶。OMX-0407 在癌症中表现出双重作用模式,直接作用于肿瘤细胞,诱导细胞周期停滞,并使肿瘤环境对免疫细胞介导的肿瘤细胞杀伤敏感。OMX-0407 正在开发为针对具有高度未满足医疗需求的实体瘤适应症的同类首创治疗药物。酪氨酸激酶通过磷酸化靶蛋白上的特定酪氨酸残基来调节癌细胞的细胞周期,从而启动细胞分裂和生长所必需的信号级联,从而在癌细胞增殖中发挥关键作用。OMX-0407 通过有效抑制癌细胞增殖所必需的相关激酶及其下游信号级联来破坏这些过程。 OMX-0407 的抗肿瘤活性在人类血管肉瘤 (AS) 的体内患者异种移植 (PDX) 模型中得到评估,该模型来自一名被诊断为上皮样血管肉瘤的 9 岁女孩。血管肉瘤是一种罕见的软组织肉瘤,治疗选择很少,且未满足的医疗需求很高。OMX-0407 在异种移植模型中表现出剂量依赖性疗效,在两种测试剂量下均有显著的肿瘤抑制作用。研究后分析显示,与已知的 OMX-0407 调节关键通路相关的磷酸化蛋白显著下调,并证实了对激酶水平的剂量依赖性治疗效果。此外,OMX-0407 在肾细胞癌 (RCC) 中表现出很强的敏感性,这通过直接活力癌细胞系筛选进行了评估。对 RCC 的进一步研究表明,人类肿瘤细胞系以及同源小鼠模型 RENCA 均有强烈的反应。这些发现与一名被诊断患有血管肉瘤且对之前的化疗有抗药性的患者的临床数据相符,在正在进行的 I 期试验 (NCT05826600) 中,OMX-0407 的治疗耐受性良好,并产生了完全持久的缓解。单一疗法中出色的临床前和临床抗肿瘤效果支持将这种有前途的药物正在进行的 I 期试验扩展到血管肉瘤和肾细胞癌。
Janus激酶在治疗和预防移植物中的抑制
移植物抗宿主病(GVHD)是同种异性造血干细胞移植(HSCT)后发病和死亡率的重要原因。多年来,皮质类固醇一直是GVHD的主要治疗方法,但是类固醇难治性GVHD的病例和高剂量皮质类固醇的严重不利影响增加了对GVHD的预防和治疗策略的需求。由于同种反应性T细胞的性质,GVHD与移植物 - 抗链球菌(GVL)效应(干细胞移植背后的治疗驱动力)固有地联系在一起。一个巨大的临床挑战是在抑制GVHD的同时保留GVL。在过去的几十年中,GVHD研究领域已大大扩展,包括T细胞调节和耗竭的进步,抗体疗法,化学治疗药,细胞疗法和Janus激酶抑制作用。在这篇综述中,我们讨论了预防和治疗GVHD的当前方法和进步,重点是Janus激酶抑制剂治疗的新新兴进步。