XiaoMi-AI文件搜索系统
World File Search SystemDNA甲基化(DM)数据格式和DMTools,以提高...
表1。DM格式和DMTools的基本信息名称名称说明类型1铬参考名称UNIT32_T 2启动1个基于1个染色体的启动,染色体unit32_t 3 End(可选)胞质或区域unit32_t 4 ml DNA DNA甲基化级别[0-1]
RnBeads – DNA 甲基化数据的综合分析
4 定制分析:RnBeads 模块 13 4.1 数据导入 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24 4.4.2 细胞类型贡献的推断....................................................................................................................25
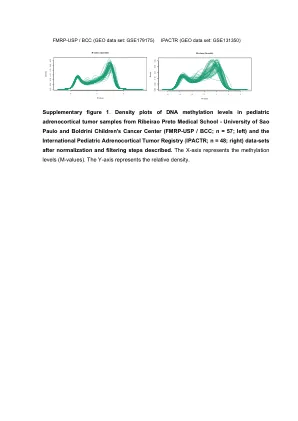
甲基化降低与糖尿病性肾病相关...
引言糖尿病患病率的上升以及发病率和死亡率的增加归因于并发症和肾脏疾病的发展仍然是全球终末期肾脏疾病(ESRD)的导致原因(1)。尽管对血糖的严格控制可以降低糖尿病性肾病(DN)(2)的风险,但尽管血糖控制充足,但许多人仍会发展为DN,而其他人则仍然无并发症,尽管血糖控制差(3)。更重要的是,很少有家庭研究表明,遗传因素在疾病进展中的作用(4),肾病患者的糖尿病患者的发生率是肾病患者的3倍以上,而不是没有肾脏疾病(5,6)。DN的遗传力仍然无法解释(7)。尽管使用国际疾病的全基因组关联研究(GWAS)进行了高通量映射的进步,包括芬兰的糖尿病性肾病(Finndi-Ane)研究,但仅确定了少数基因并说明
吸烟对全基因组 DNA 甲基化的影响......
背景:通过表观基因组关联研究 (EWAS) 确定的吸烟相关 DNA 甲基化水平通常归因于吸烟反应机制,但共同的遗传易感性对吸烟和 DNA 甲基化水平的影响通常没有被考虑到。方法:我们利用一种强大的家庭内设计,即不一致的同卵双胞胎设计,来研究血细胞 DNA 甲基化对吸烟的反应性以及戒烟后甲基化模式的可逆性。Illumina HumanMethylation450 BeadChip 数据可用于 769 对同卵双胞胎(平均年龄 = 36 岁,范围 = 18-78 岁,70% 为女性),包括目前或以前吸烟情况不一致或一致的双胞胎。结果:在目前吸烟情况不一致的双胞胎中,在目前吸烟的双胞胎和从不吸烟的基因同卵双胞胎之间发现了 13 个差异甲基化 CpG。排名靠前的位点包括 CACNA1D 和 GNG12 中的多个 CpG,它们分别编码钙电压门控通道和 G 蛋白的亚基。这些蛋白质与烟碱乙酰胆碱受体相互作用,表明这些 CpG 上的甲基化水平可能对尼古丁暴露有反应。所有 13 个 CpG 均曾与无关个体的吸烟有关,而以前吸烟情况不一致的同卵双胞胎的数据表明,戒烟后甲基化模式在很大程度上是可逆的。我们进一步表明,对于目前都是吸烟者但吸烟数量不同的同卵双胞胎,其吸烟水平暴露的差异反映在他们的 DNA 甲基化谱中。结论:总之,通过分析同卵双胞胎的数据,我们有力地证明了人类血细胞中的 DNA 甲基化水平对吸烟有反应。资金:我们感谢美国国家药物滥用研究所 DA049867 拨款、荷兰科学研究组织 (NWO):生物银行和生物分子研究基础设施 (BBMRI-NL, NWO 184.033.111) 和 BBRMI-NL 资助的 BIOS 联盟 (NWO 184.021.007)、NWO 大型基础设施 X-Omics (184.034.019)、行为遗传和遗传流行病学研究的基因型/表型数据库 (ZonMw Middelgroot 911-09-032);荷兰双胞胎登记库:研究基因组和环境之间的相互作用 (NWO-Groot 480-15-001/674);美国苏福尔斯 Avera 研究所和美国国立卫生研究院(NIH R01 HD042157-01A1、MH081802、Grand Opportunity 拨款 1RC2 MH089951 和
公牛精子的 DNA 甲基化:进化的影响……
摘要:精子的 DNA 甲基化组是由一种独特的表观遗传重编程引起的,这种重编程对于染色质压缩和保护父系遗传至关重要。尽管公牛精液广泛用于人工授精 (AI),但人们对牛精子表观基因组知之甚少。本综述的目的是根据在人类和模型物种中积累的知识,综合最近对公牛精子甲基化组的研究。我们将讨论精子特异性 DNA 甲基化特征及其潜在的进化影响,特别强调低甲基化区域和重复元素。我们将回顾最近与生育力和年龄相关的公牛精子甲基化组的个体间变异性和个体内可塑性的例子。最后,我们将讨论受精后的父系甲基化组重编程,以及可能涉及表观遗传的机制,并提供一些改变牛重编程动态的干扰的例子。由于人工智能公牛的选择与其基因型密切相关,我们还将讨论序列多态性和 DNA 甲基化之间的复杂相互作用,这既代表了解决 DNA 甲基化在塑造表型中的作用的困难,也代表了更好地理解基因组可塑性的机会。
CRISPR/dCas9-Tet1介导的DNA甲基化编辑
DNA甲基化是许多生物过程的关键表观遗传机制,其异常调控与人类多种疾病密切相关。精准操控DNA甲基化有望增进我们对这一关键机制的理解,并开发新的治疗方法。此前,我们只能通过小分子(如5-氮杂-2-脱氧胞苷)或无针对性地干扰相关基因(如DNA甲基转移酶)来改变全基因组的DNA甲基化,这使得研究这种表观遗传标记在特定基因组位点的功能意义变得十分困难。通过将DNA去甲基化过程中的关键酶(Ten-eleven易位双加氧酶1,Tet1)的催化结构域与可重编程的序列特异性DNA靶向分子蛋白dCas9融合,我们开发了一种DNA甲基化编辑工具(dCas9-Tet1),可以有针对性地对特定基因组位点进行去甲基化。 dCas9-Tet1 系统使我们能够仅通过替换单个向导 RNA 来研究几乎任何给定位点的 DNA 甲基化作用。本文,我们描述了一种方案,该方案能够使用 dCas9-Tet1 系统高效、特异性地对各种细胞培养物中特定基因组位点的 DNA 甲基化进行模块化和可扩展的操作。
区域DNA甲基化对基因表达的影响
摘要DNA甲基化对仓鼠腺嘌呤磷酸蛋白酶基转移酶(APRT)和疱疹胸苷激酶(TK)基因的跨遗传活性的影响。通过使用包含这些基因序列的M13构建体,使用限制性片段启动引物第二链合成在体外甲基化的特定段使用底物2'-脱氧-5-甲基-5-甲基 - 胞迪三丁烷三磷酸(DMCTP)。通过DNA-MEDI-ETED共转移将这些杂交甲基化分子插入小鼠LTK细胞中。在所有情况下,整合序列都保留了体外定向的甲基化模式。在5'区域中CpG甲基化抑制了APRT基因,但在3'端或相邻的M13序列中未能通过甲基化来进行。与此相反,在5'启动子区域和TK基因的3'结构区域中的DNA甲基化都具有很强的抑制作用。这表明这种修饰可能会通过不涉及RNA聚体识别序列直接改变的机制影响转录。
肌核DNA甲基化的协调调节...
1营养,NEBRACK的统一,NE 68583,美国学院,瑞典17177,瑞典,瑞典,瑞典,瑞典,瑞典,48309,US 48309,US 48309,US和美国72701
正常粘膜中的DNA-甲基化变异性
结果:在558个独特基因座的健康个体中,近端结肠内有AP的个体的正常剖腹组织表现出失调的DNA甲基化COM。利用这些与腺瘤相关的差异性可变和甲基化的CPG(ADVMC),我们的分类器在Swepic数据集(接收器操作器操作特征曲线下[ROCAUC]¼0.63-0.81)之间识别了健康和AP-ADJACECT的组织(接收器工作特征曲线下的交叉验证区域),包括年龄在年龄范围内。在3个外部组中验证了这种歧视能力,与癌症的组织有区别(ROC AUC¼0.82-0.88)。值得注意的是,ADVMC失调与息肉多重性相关。超过50%的ADVMC与年龄显着相关。这些ADVMC富含基因组的活性区域(P <.001),相关基因在AP-ADJACACENT组织中表现出改变。