XiaoMi-AI文件搜索系统
World File Search System标题 急诊科潜在 SARS-CoV-2 预防和治疗药物简介
截至 2020 年 3 月 30 日,美国共有 161,807 例 SARS-CoV-2 病例和 2,953 例死亡病例,预计病例数还会上升。除支持性治疗外,对于从急诊科 (ED) 出院或住院的患者,没有针对 SARS-CoV-2 的特异性治疗方法。此外,也没有疫苗可以保护我们处于危险中的医护人员。美国国立卫生研究院正在进行 1 期临床试验以评估潜在疫苗,接种者已开始接种该研究性疫苗。2 我们简要概述了正在研究的潜在预防和治疗药物,其中一些药物如果被证明有效,可以在急诊科开始使用。[West J Emerg Med. 2020;21(3)510–513.]
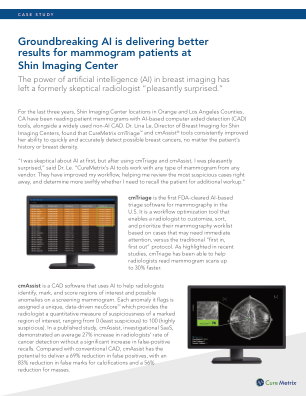
开创性的 AI 为 Shin Imaging Center 的乳房 X 光检查患者带来更好的结果
cmAssist 是一款 CAD 软件,它使用 AI 帮助放射科医生识别、标记和评分筛查乳房 X 光检查中的感兴趣区域和可能异常。它标记的每个异常都会被分配一个独特的数据驱动的 neuScore ™,该 neuScore ™ 为放射科医生提供了标记感兴趣区域可疑程度的定量测量,范围从 0(最不可疑)到 100(高度可疑)。在一项已发表的研究中,cmAssist(研究性 SaaS)显示放射科医生的癌症检测率平均提高了 27%,而假阳性召回率没有显著增加。与传统 CAD 相比,cmAssist 有可能将假阳性率降低 69%,将钙化假标记率降低 83%,将肿块假标记率降低 56%。
样本一般限制和排除
- 您的太平洋计划不涵盖实验,研究或未经证实的治疗。,我们是指服务,供应,方案,程序,设备,化学疗法,药物或药物,或者在其诊断和治疗患者的诊断和治疗方面使用的服务,化学疗法,药物或药物。它包括何时及以实现的治疗方法:除了实验,研究或未经证实或临床测试以外,尚未获得美国政府机构批准(例如FDA);在您的政策发行状态或医疗顾问,医疗协会和/或技术资源确定的情况下,不是公认的医学实践;未经Medicare和Medicaid服务中心批准报销;与医学或其他研究有关;或任何政府机构或细分都认为是实验性,研究性或未经证实的,不合理和必要的,或任何类似的发现。
Bexsero;B 群脑膜炎球菌疫苗备忘录
ACIP 免疫实践咨询委员会 ADEM 急性播散性脑脊髓炎 aHUS 非典型溶血性尿毒症综合征 CBER 生物制品评估与研究中心 CDC 疾病控制与预防中心 DE 流行病学部 EMA 欧洲药品管理局 fHBP 因子 H 结合蛋白 GBS 格林-巴利综合征 GSK 葛兰素史克 IND 研究性新药 NadA 奈瑟氏菌粘附素 A NHBA 奈瑟氏菌肝素结合抗原 OBE 生物统计和流行病学办公室 OMIC 其他医学上重要的疾病 PAER 定期不良反应报告 PMC 上市后承诺 PMR 上市后要求 PREA 儿科研究公平法案 RMP 风险管理计划 SIDS 婴儿猝死综合征 VAERS 疫苗不良事件报告系统 US 美国
疫苗和相关生物制品咨询委员会 2021 年 6 月 10 日会议简报文件 - FDA
词汇表 BEST 生物制品有效性和安全性 BLA 生物制品许可申请 CBRN 化学、生物、放射或核 CFR 联邦法规 CMC 化学、制造和控制 CMS 医疗保险和医疗补助服务中心 COVID-19 2019 年冠状病毒病 EUA 紧急使用授权 FDA 食品药品管理局 GMT 几何平均滴度 HHS 美国卫生与公众服务部 IND 研究性新药 PMC 许可后承诺 PMR 许可后要求 SARS-CoV-2 严重急性呼吸综合征冠状病毒 2 VRBPAC 疫苗和相关生物制品咨询委员会 MIS-C 儿童多系统炎症综合征 PREA 儿科研究公平法案 PVP 药物警戒计划 VE 疫苗有效性 CDC 疾病控制和预防中心 VAERS 疫苗不良事件报告系统 VOC 值得关注的变体 VSD 疫苗安全数据链接 US 美国
SHIF成员的摘要计划说明...
验证资格的验证,请参见ID卡的背面拨打此号码,以在收取费用之前验证计划福利的资格。医疗福利本时间表中描述的所有福利都受到本文更充分描述的排除和限制,包括但不限于计划管理员的决心:护理和治疗是医学上必要的;该服务,供应和护理不是实验性和/或研究性的。这些条款的含义在本文档的定义术语部分中。本文档中只包括对本计划涵盖的健康益处的一般描述。任何计划参与者都可以免费提供更详细的承保时间表,他们要求从计划管理员那里要求一个。注意:您的计划可能要求必须先进行某些服务或从计划中报销某些服务。请参阅您的计划的医疗福利时间表,以了解有关服务授权要求的更多详细信息,请参见“成本管理”部分。
计划概要说明 PPB 计划 C - PEIA
实验性、研究性或未经证实的程序:计划确定(在就特定案件的承保做出决定时)以下医疗、外科、诊断、精神病、药物滥用或其他医疗保健技术、用品、治疗、程序、药物疗法或设备:(1) 未经美国食品药品管理局 (FDA) 批准合法用于拟议用途且未在美国医学会药物评估中被认定为适用于拟议用途;或 (2) 须经任何机构审查委员会对拟议用途进行审查和批准;或 (3) 是受 FDA 监督的正在进行的临床试验的主题;或 (4) 未经现行的同行评审医学文献证明可安全有效地治疗或诊断其拟议用途的状况或疾病。针对晚期癌症和其他危及生命状况的符合某些法定标准的第 2 和第 3 期临床试验尽管属于实验性,但仍将获得承保。
计划概要说明 计划 A、B 和 D - PEIA - WV.gov
实验性、研究性或未经证实的程序:医疗、外科、诊断、精神病、药物滥用或其他医疗保健技术、用品、治疗、程序、药物疗法或设备,该计划(在就特定案件的承保做出决定时)确定为:(1) 未经美国食品药品管理局 (FDA) 批准合法用于拟议用途,且未在美国医学会药物评估中被认定为适用于拟议用途;或 (2) 须经任何机构审查委员会对拟议用途进行审查和批准;或 (3) 是受 FDA 监督的正在进行的临床试验的主题;或 (4) 未经现行的同行评审医学文献证明可安全有效地治疗或诊断其拟议用途的状况或疾病。针对晚期癌症和其他危及生命状况的符合某些法定标准的第 2 和第 3 期临床试验尽管属于实验性,但仍将获得承保。
lifileucel 悬浮液 (Amtagvi) MNG-066
• 不受控制的脑转移;或 • 器官移植或之前的细胞转移;或 • 葡萄膜或眼部黑色素瘤;或 • 因任何原因接受全身性类固醇治疗;或 • 肿瘤切除前 14 天内出现 2 级或以上出血;或 • 左心室射血分数 (LVEF) < 45%;或 • 纽约心脏协会 (NYHA) 心力衰竭分类大于 1;或 • 1 秒用力呼气量 (FEV 1 ) < 60% 考虑服务时 研究性保险不适用于研究性医疗治疗或程序、药物、设备或生物制品。根据对现有数据的审查,健康计划认为,当患者选择标准未得到满足时(除上述标记为非医学必要** 的患者外),lifileucel(Amtagvi)的使用属于研究性质。*背景/概述 Amtagvi 是一种肿瘤衍生的自体 T 细胞免疫疗法,用于治疗成人不可切除或转移性黑色素瘤,这些黑色素瘤患者之前曾接受过程序性死亡受体 1 (PD-1) 阻断抗体治疗,如果 BRAF V600 突变呈阳性,则使用 BRAF 抑制剂(可联合或不联合 MEK 抑制剂)。它由从一个或多个肿瘤病变中切除的患者肿瘤组织制成,主要由 CD4+ 和 CD8+ T 细胞谱系的 T 细胞组成。输注前,患者应接受淋巴细胞清除化疗,包括环磷酰胺和氟达拉滨。Amtagvi 在完成淋巴细胞清除化疗后 24 小时至 4 天内给药。完成 Amtagvi 输注后,静脉注射白细胞介素 2 (IL-2),以 Proleukin ®‡(阿地白介素 IV 输注)的形式给药,最多 6 剂(每 8-12 小时给药一次)以支持体内细胞扩增。治疗必须在制造商认证的治疗中心进行。该产品标签上有治疗相关死亡、长期严重血细胞减少、心脏疾病、呼吸衰竭和急性肾衰竭的黑框警告。
门诊事件监测器和移动心脏门诊遥测
症状不频繁出现(少于每 48 小时一次)的个人 已接受非诊断性 Holter 监测以检查提示有心律失常症状(即心悸、头晕、晕厥前兆或晕厥)的个人。 已接受导管消融治疗且正在考虑停止全身抗凝治疗或需要记录心律失常消融手术结果的个人。 已开始或停止抗心律失常药物治疗以记录干预结果的个人。 患有隐源性卒中且心房颤动 (AF) 标准检查结果为阴性且 24 小时 Holter 监测结果可能无法诊断的个人。 怀疑有心脏缺血以记录心电图变化的个人。 在任何给定的 30 天内使用 AEM 超过一次并非医学上必要。所有其他适应症的外部门诊事件监测器的使用均视为研究性的。目前尚无足够证据支持关于此程序相关的健康结果或益处的一般性结论。