XiaoMi-AI文件搜索系统
World File Search SystemIRF8 突变型 B 细胞淋巴瘤通过 CD74 依赖的 MHC CII 复合物中抗原加工和呈递的失调来逃避免疫
1. 血液学和肿瘤内科,梅斯癌症中心,德克萨斯大学健康科学中心圣安东尼奥,德克萨斯州圣安东尼奥,78229,美国。2. 生物化学和结构生物学系,德克萨斯大学健康科学中心圣安东尼奥,德克萨斯州圣安东尼奥,78229,美国。3. 南德克萨斯退伍军人医疗保健系统,奥迪墨菲退伍军人医院,德克萨斯州圣安东尼奥,78229,美国。 * 同等贡献 # 联系人:Ricardo Aguiar,医学博士,哲学博士 血液学和肿瘤内科 UT 健康圣安东尼奥分校 电子邮件:aguiarr@uthscsa.edu
特刊
“合成致死”被定义为两个单独基因同时发生的改变之间的遗传相互作用,导致细胞死亡。合成致死已成为设计联合疗法或新型抗癌药物的一种有前途的方法。PARP 抑制剂 (PARPi) 是第一种利用合成致死设计的临床抗癌药物,它们在治疗 BRCA1/2 突变型癌症方面取得了巨大成功。尽管 PARPi 是 BRCA1/2 突变型卵巢癌的一线维持疗法,但必需或从头耐药性阻碍了其临床疗效。因此,需要新的“合成致死”伙伴和靶点来设计新型抗癌疗法。此外,迫切需要有效的组合策略来克服 PARPi 耐药性。因此,本期特刊将接受包括但不限于基于“合成致死”的新型抗癌疗法、探索抗癌疗法的新机制、克服PARPi的新型组合策略以及抗癌药物的新型分子靶点和作用机制的投稿。
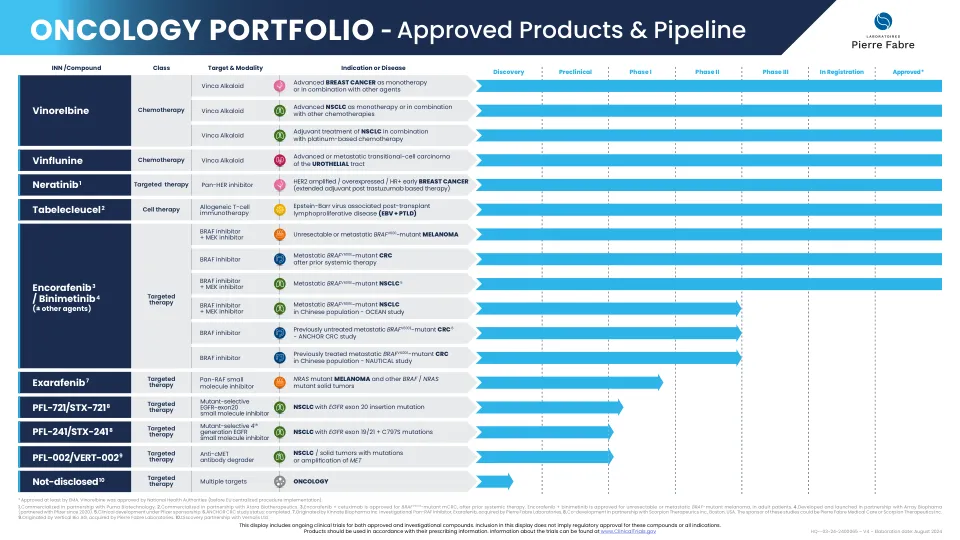
肿瘤学产品组合 - 已获批准的产品和研发管线
1. 与 Puma Biotechnology 合作进行商业化。2. 与 Atara Biotherapeutics 合作进行商业化。3. Encorafenib + 西妥昔单抗获批用于治疗 BRAF V600E 突变型 mCRC,此前已接受全身治疗。Encorafenib + binimetinib 获批用于治疗成人患者的不可切除或转移性 BRAF 突变型黑色素瘤。4. 与 Array Biophama(自 2020 年起与辉瑞合作)合作开发和推出。5. 在辉瑞的赞助下进行临床开发。6. ANCHOR CRC 研究状态:已完成。7. 由 Kinnate Biopharma Inc. 发起。研究性泛 RAF 抑制剂 Exarafenib 被 Pierre Fabre Laboratories 收购。8. 与美国波士顿的 Scorpion Therapeurics Inc. 合作共同开发。这些研究的资助方可能是 Pierre Fabre Medical Care 或 Scorpion Therapeutics Inc。9. 由 Vertical Bio AG 发起,后被 Pierre Fabre Laboratories 收购。10. 与 Vernalis Ltd. 建立发现伙伴关系。
预防脑转移瘤:新领域
摘要:本综述讨论了预防最常见的实体肿瘤类型(即肺癌、乳腺癌和黑色素瘤)的脑转移这一主题。在每种肿瘤类型中,脑转移的风险与疾病状态和分子亚型有关(即 EGFR 突变型非小细胞肺癌、HER2 阳性和三阴性乳腺癌、BRAF 和 NRAF 突变型黑色素瘤)。预防性颅脑照射是小细胞肺癌患者的标准治疗方法,这些患者对化疗有反应,但代价是晚期神经认知能力下降。最近,临床试验证明,几种能够靶向驱动肿瘤生长的分子改变的分子药物可有效预防脑部二次复发。EGFR 突变或 ALK 重排的非小细胞肺癌抑制剂、用于 HER2 阳性乳腺癌的 Tucatinib 和曲妥珠单抗-德鲁替康以及用于黑色素瘤的 BRAF 抑制剂就是这种情况。强调对有脑转移风险的无症状患者进行 MRI 筛查的必要性。
利用 AAV5 传递的 Life Edit ® 核酸酶和引导 RNA 进行等位基因选择性 SNP 编辑,显著减少突变型 HTT 蛋白
我们的平台 Life Edit 的基因组编辑平台提供了大量且多样化的新型 RNA 引导核酸酶 (LEG)、碱基编辑器和逆转录酶编辑器,可提供灵活的编辑策略和前所未有的访问感兴趣的基因组位点的机会。我们的平台源自 AgBiome 不断增长的数万种专有非致病性微生物集合。
利用 AAV5 传递的 Life Edit ® 核酸酶和引导 RNA 进行等位基因选择性 SNP 编辑,从而显著减少突变型 HTT 蛋白
LEG-B-SGN2 靶向 'T' SNP 不影响来自健康供体的成纤维细胞系中的 wtHTT 蛋白,该成纤维细胞系为 rs362331 纯合子(C/C) LEG-B-SGN2 靶向 'T' SNP 不影响来自患者的成纤维细胞系中的 wtHTT 蛋白,该成纤维细胞系为 rs362331 杂合子(C/T),CAG 重复扩增与 'T' 等位基因同步
奥希替尼诱发间质性肺病后,用阿莫替尼成功治疗 EGFR T790M 突变型非小细胞肺癌:病例报告
第三代EGFR-TKI,如奥希替尼,可以抑制第一代和第二代TKI引起的获得性耐药(11,12),但奥希替尼可带来多种药物引起的毒性,包括间质性肺病(ILD),有时甚至是致命的。奥希替尼诱发ILD后病例报道较少,且尚无标准治疗方法。本文我们报道一例EGFR T790M阳性晚期肺腺癌患者在奥希替尼治疗后发生3级ILD,换用新型第三代EGFR-TKI阿美替尼后成功治愈,并通过文献综述探讨了阿美替尼的临床疗效和副作用。我们根据 CARE 报告清单(网址为 http://dx.doi.org/10.21037/atm-21-2823)提交了以下文章。
BRAF 抑制剂的脱靶会破坏内皮信号传导和血管屏障功能
针对突变型 BRAF 的靶向疗法与 MEK 抑制剂 (MEKi) 联合使用可有效治疗晚期黑色素瘤。然而,治疗成功率会受到耐药性和不良事件 (AE) 的影响。已获批准的 BRAF 抑制剂 (BRAFi) 表现出高水平的靶标混杂性,这可能会导致这些影响。血管内壁与高血浆浓度的 BRAFi 直接接触,但抑制剂对这种细胞类型的影响尚不清楚。因此,我们旨在描述血管内皮对已获批准的黑色素瘤 BRAFi 的反应。我们发现临床批准的 BRAFi 诱导了内皮 MAPK 信号的矛盾激活。此外,磷酸化蛋白质组学显示每种抑制剂都有不同的脱靶组。使用维莫非尼和下一代二聚化抑制剂 PLX8394 治疗后,内皮屏障功能和连接完整性受损,但使用达拉非尼或恩科拉非尼则没有。总之,这些发现有助于深入了解 BRAFi 对内皮信号和功能产生的惊人不同副作用。更好地了解脱靶效应有助于确定不良反应背后的分子机制,并指导 BRAF 突变型黑色素瘤疗法的持续发展。
KRAS 突变非小细胞肺癌的个性化治疗之路......
综述目的:总结Kirsten大鼠肉瘤病毒致癌基因同源物(KRAS)突变型非小细胞肺癌(NSCLC)的靶向治疗和免疫治疗,并讨论正在进行的临床试验。近期发现:大约30%的NSCLC患者发生KRAS突变,是肺癌中第二常见的基因变异。40年来,它一直被认为是“无药可治的”,直到发现KRAS G12C的直接抑制剂。sotorasib和MRTX849等有前景的直接KRAS G12C抑制剂在经过一线治疗后,在KRAS G12C突变型晚期/转移性NSCLC患者中取得了突破性进展,显示出良好的抗肿瘤效果。继免疫检查点抑制剂(ICI)在NSCLC中取得成功后,许多携带KRAS突变的患者可以从ICI中受益。然而,由于疾病的异质性,患者的预后仍然不令人满意,为个性化治疗方案留下了空间,例如新的靶向治疗和其他治疗。摘要:在这篇综述中,我们旨在分析这些肿瘤的临床试验策略,从少数化疗方案转向靶向和免疫治疗,在 KRAS 突变 NSCLC 亚型的分子选择背景下。关键词:非小细胞肺癌,KRAS G12C 突变,靶向治疗,免疫治疗
靶向组蛋白去乙酰化酶增强Erastin诱导的铁死亡对EGFR激活突变肺腺癌的治疗效果
肺癌是死亡率最高的恶性肿瘤,而肺腺癌(LUAD)占所有肺癌的40%(1)。在亚洲,表皮生长因子受体(EGFR)是LUAD最常见的驱动突变,发生率为55%(2-4),其中EGFR激活突变在全球占17.4%,在中国占37.3%(5)。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)目前是EGFR突变LUAD患者的标准一线治疗方案(6)。尽管使用EGFR-TKI已为晚期EGFR突变型NSCLC患者带来显著的临床获益和前所未有的生存率提高(7-10),但不可避免地会产生获得性耐药。继发性EGFR突变,包括EGFR-T790M突变和EGFR结构域内的其他突变、MAPK、PI3K和细胞周期基因的突变以及EGFR或其他致癌基因如MET的扩增,导致LUAD细胞获得性EGFR-TKI耐药(11-13)。但有些患者在缺乏已知耐药机制的情况下获得了EGFR-TKI耐药。因此,内在性EGFR-TKI耐药是临床上的一个挑战。据报道,大约20%-30%的EGFR突变型LUAD对EGFR-TKI具有内在性耐药(14)。因此,如何克服这些获得性和内在性的EGFR-TKI耐药一直是临床关注的焦点。