XiaoMi-AI文件搜索系统
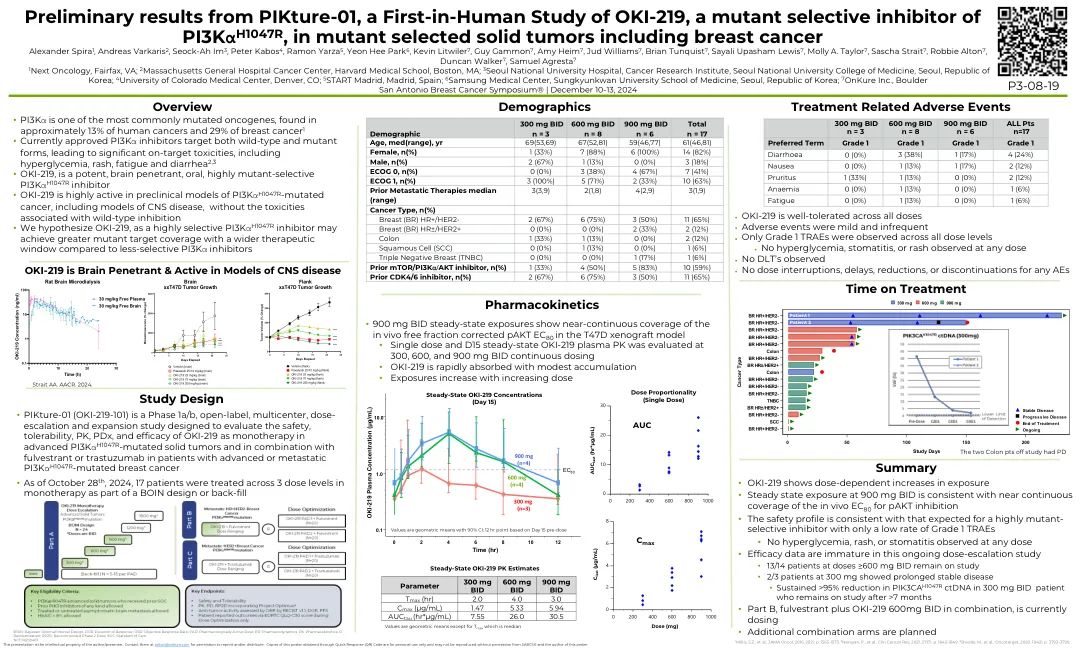
World File Search SystemPIKture-01 的初步结果,这是一项针对 OKI-219(PI3K α H1047R 突变选择性抑制剂)的首次人体研究,用于治疗突变型选定实体瘤
概述 • PI3K α 是最常见的突变致癌基因之一,在约 13% 的人类癌症和 29% 的乳腺癌中发现 1 • 目前批准的 PI3K α 抑制剂靶向野生型和突变型,导致显著的靶向毒性,包括高血糖、皮疹、疲劳和腹泻 2,3 • OKI-219 是一种强效、脑渗透性、口服、高度突变选择性 PI3K α H1047R 抑制剂 • OKI-219 在 PI3K α H1047R 突变癌症的临床前模型(包括中枢神经系统疾病模型)中具有高度活性,但没有与野生型抑制相关的毒性 • 我们假设 OKI-219 作为一种高度选择性 PI3K α H1047R 抑制剂,与选择性较低的 PI3K α 抑制剂相比,可以实现更大的突变靶标覆盖率和更宽的治疗窗口
亨廷顿氏病动物模型中微小RNA表达的改变及潜在的治疗策略
摘要 回顾近年来的亨廷顿舞蹈症动物模型,发现许多microRNA在纹状体和大脑皮层中的表达水平发生改变,且大多下调。发生改变的microRNA包括miR-9/9*、miR-29b、miR- 124a、miR-132、miR-128、miR-139、miR-122、miR-138、miR-23b、miR-135b、miR- 181(均下调)和miR-448(上调),类似的变化此前也在亨廷顿舞蹈症患者中发现过。在动物细胞研究中,发生改变的microRNA包括miR-9、miR-9*、miR-135b、miR-222(均下调)和miR-214(上调)。在动物模型中,miR-155 和 miR-196a 的过表达导致突变型亨廷顿蛋白 mRNA 和蛋白质水平下降,纹状体和皮质中的突变型亨廷顿蛋白聚集体降低,并改善行为测试中的表现。miR-132 和 miR-124 的过表达也使行为测试中的表现得到改善。在动物细胞模型中,miR-22 的过表达增加了感染突变型亨廷顿蛋白的大鼠原代皮质和纹状体神经元的活力,并减少了 ≥ 2 µm 的亨廷顿蛋白富集灶。此外,miR-22 的过表达提高了用 3-硝基丙酸处理的大鼠原代纹状体神经元的存活率。外源性表达 miR-214、miR-146a、miR-150 和 miR-125b 会降低 Hdh Q111 / Hdh Q111 细胞中内源性亨廷顿蛋白 mRNA 和蛋白质的表达。有必要对亨廷顿氏病动物模型进行进一步研究,以验证这些发现,并确定特定的microRNA,它们的过度表达可抑制突变亨廷顿蛋白的产生和其他有害过程,并可能为治疗亨廷顿氏病患者和减缓其进展提供更有效的方法。关键词:动物模型;大脑皮层;亨廷顿蛋白;亨廷顿氏病;microRNA;神经退行性;纹状体;治疗策略
p53 在乳腺癌进展中的作用
转录因子 p53 是多种细胞过程的重要调节因子。在存在基因毒性应激的情况下,p53 被激活以促进 DNA 修复、细胞周期停滞和细胞凋亡。在乳腺癌中,p53 的肿瘤抑制活性经常因其负调节因子 MDM2 的过度表达或突变而失活,30-35% 的乳腺癌病例都存在突变。值得注意的是,乳腺癌中 p53 突变的频率高度依赖于亚型,大多数激素受体阳性或管腔亚型保留野生型 p53 状态,而激素受体阴性患者主要携带 p53 突变,具有获得功能致癌活性,导致预后较差。因此,针对不同乳腺癌亚型中的野生型和突变型 p53 的双管齐下策略可能具有临床意义。近年来,基于 p53 的疗法发展迅速,包括独特的小分子化学抑制剂、钉合肽、PROTAC,以及使用载体和工程抗体的几种基于基因的方法。在这篇综述中,我们重点介绍了处于临床前和临床开发阶段的治疗策略,以克服野生型和突变型 p53 乳腺肿瘤中的 p53 失活,并讨论了它们在临床前和临床环境中的功效和局限性。
DCC-3116 概述和临床前数据
本演示文稿可能包含基于我们当前对行业的期望、估计和预测以及管理层的信念和假设的前瞻性陈述。“预期”、“预计”、“打算”、“计划”、“相信”、“寻求”、“估计”、“可能”、“将”等词语及其变体或类似表达旨在识别前瞻性陈述。这些声明包括但不限于:我们对 DCC-3116 在患有突变型 RAS 或 RAF 癌症的患者中进行的 1 期研究的预期和时间安排、DCC-3116 1 期研究剂量递增阶段的初步数据、根据卫生当局的反馈,扩大 DCC-3116 研究以在非小细胞肺癌患者中添加与突变型 KRAS G12C 抑制剂联合治疗的队列、探索 DCC-3116 与多种其他靶向肿瘤药物的临床前联合用药、临床研究(包括状态、进展和结果)、临床数据读取时间安排、未来临床研究的规划工作、NDA/MAA(及同等)申请和潜在的其他批准、研究和发现工作(包括我们候选药物的潜力)、IND 申请、监管指定和计划、成功的时间和可能性、未来运营的管理计划和目标、估计的患者人数、我们药物和候选药物的市场机会以及业务指导,包括发现、临床和监管里程碑、现金指导和COVID-19,并且仅在准备本演讲时发言。此类陈述基于以下信息
针对 p53 R175H 突变表位的 DNA 递送单克隆抗体可抑制小鼠肿瘤发展
摘要 肿瘤抑制基因 p53 是癌症中最常见的突变基因,其中 R175H 是最常见的 p53 错义突变。然而,目前还没有针对突变 p53 的靶向疗法或免疫疗法获得批准。在这里,我们表征并研究了一种识别突变 p53-R175H 的单克隆抗体 (mAb),以了解其亲和力、特异性和体外抗肿瘤细胞活性。然后,我们将表达抗 R175H mAb 或双特异性抗体 (BsAb) 的 DNA 质粒递送到小鼠体内,以评估其治疗效果。我们的结果表明,抗 R175H mAb 以高亲和力特异性结合 p53-R175H 抗原,并识别 HEK293T 或 MC38 细胞上表达的人类突变型 p53-R175H 抗原,与野生型 p53 无交叉反应。在培养细胞中,抗 R175H mAb 表现出比对照更高的细胞毒性,但不会诱导抗体依赖性细胞毒性。我们在敲除内源性突变型 p53 等位基因后,制作了重组 MC38 小鼠细胞系 (MC38-p53-R175H),该细胞系过表达人类 p53-R175H。在体内,施用抗 R175H mAb 质粒对小鼠的 MC38-p53-R175H 产生了强大的抗肿瘤作用。抗 R175H BsAb 质粒的给药没有显示出治疗效果,但与抗 PD-1 抗体联合使用时观察到了强大的抗肿瘤活性。这些结果表明,针对特定突变表位使用
反义寡核苷酸可作为 1 型强直性肌营养不良症中观察到的脑功能障碍的潜在治疗方法
强直性肌营养不良症,或 1 型强直性肌营养不良症 (DM1),是一种多系统性疾病,是成人最常见的肌营养不良症。它不仅影响肌肉,还影响许多器官,包括大脑。脑损伤包括认知缺陷、白天嗜睡以及视觉空间和记忆功能丧失。具有 CUG 重复的突变转录本的表达导致毒性 mRNA 功能的增强。反义寡核苷酸 (ASO) 策略治疗 DM1 脑缺陷的局限性在于 ASO 在全身给药后不会穿过血脑屏障,这表明应考虑其他给药方法。ASO 技术已成为开发多种人类疾病潜在新疗法的有力工具,其潜力已在最近的临床试验中得到证实。使用 IONIS 486178 ASO 靶向来自 DM1 患者人类诱导性多能干细胞的神经细胞中的 DMPK mRNA,可消除 CUG 扩增灶,实现 MBNL1/2 的核重新分布,并纠正异常剪接。在 DMSXL 小鼠脑室内注射 IONIS 486178 ASO 可使不同脑区中突变型 DMPK mRNA 的水平降低高达 70%。它还可逆转新生儿给药后的行为异常。本研究表明,IONIS 486178 ASO 靶向脑中的突变型 DMPK mRNA,并强烈支持基于鞘内注射 ASO 治疗 DM1 患者的可行性。
三氧化二砷具有细胞毒性和放射增敏作用......
我们评估了 ATO 对不同儿科 SHH-MB 细胞系(ONS-76:TP53 - 野生型;DAOY 和 UW402:TP53 - 突变型)的潜在影响。确认了 MB 细胞系分子亚群并验证了 TP53 突变。单独使用不同浓度(1-16 µ M)的 ATO 处理或与辐射剂量(0.5、1、2 和 4 Gy)组合处理后评估了细胞活力、克隆形成能力和细胞凋亡。通过 WB 评估了 Rad51 和 Ku86 蛋白。ATO 处理降低了所有 SHH-MB 细胞系的细胞活力。ATO 暴露后还观察到克隆形成能力显著下降和细胞凋亡率升高,SHH-MB TP53 - 突变型的细胞死亡更明显(> 70%)。 ATO 与放射治疗联合治疗也减少了 UW402 肿瘤细胞中的菌落形成,这与 DNA 损伤修复蛋白 Rad51 和 Ku86 无关。计算机模拟分析表明,来自细胞周期和 p53 通路的一组基因在 SHH 肿瘤亚型中存在差异表达,这表明细胞系可能根据基因表达谱对疗法产生反应。在此,我们展示了 ATO 在儿童 SHH 细胞系中的细胞毒性,对 MB-SHH TP53 突变细胞具有明显的放射增敏作用。这些结果突出了 ATO 单独或与放射疗法联合使用的潜力,支持进一步的临床研究。
扩展和转化癌症合成弱点
9:30-9:40 通过 ATX020 抑制 KIF18A,可通过与染色体不稳定性发生的合成致死相互作用导致有丝分裂停滞和强大的抗肿瘤活性* Maureen Lynes,Accent Therapeutics,马萨诸塞州列克星敦 9:40-9:45 讨论/问答 9:45-9:55 Nimbolide 靶向 RNF114 诱导 PARP1 的捕获和 BRCA 突变癌症中的合成致死* Yonghao Yu,哥伦比亚大学瓦格洛斯内科与外科医学院,纽约,纽约 9:55-10:00 讨论/问答休息 上午 10:00-10:30 | Grand Salon Opera Foyer 不符合 CME 资格 全体会议 2:合成致死机制 上午 10:30-12:30 | Grand Salon Opera AB 会议主席:Zuzana Tothova,Dana-Farber 癌症研究所,马萨诸塞州波士顿 CME 合格 10:30-10:50 黏连蛋白突变型髓系恶性肿瘤的治疗脆弱性 Zuzana Tothova 10:50-11:00 讨论/问答 11:00-11:20 SWI/SNF 突变型癌症的合成致死率 Charles W.M.Roberts,圣犹大儿童研究医院,田纳西州孟菲斯 11:20-11:30 讨论/问答 11:30-11:50 RAP1GDS1 的长异构体是 RAS 驱动的肺腺癌中的合成脆弱性 E. Alejandro Sweet-Cordero,加利福尼亚大学旧金山分校,加利福尼亚州旧金山
BRAF 突变型甲状腺癌患者通过饲管给药后维莫非尼和考比替尼的疗效和毒性与血浆浓度的关系:病例系列和文献综述
摘要 简介 原癌基因 B-Raf 抑制剂 (BRAFi) 维莫非尼与丝裂原活化蛋白激酶激酶 (MEKi) 抑制剂考比替尼联合使用,已被证明可改善 BRAF V600 突变黑色素瘤患者的生存期。BRAF 突变也是其他肿瘤类型(包括甲状腺癌)中经常检测到的驱动突变。由于甲状腺癌不是 BRAF/MEKi 的标称适应症,因此在药物重新发现方案 (DRUP) 中开设了一个针对 BRAF V600 突变甲状腺癌患者队列,这是一项正在进行的全国性泛癌症多药试验,患者根据其分子肿瘤特征接受已批准药物的标签外治疗。 结果 在这里,我们介绍了两例 BRAF 突变甲状腺癌患者,他们通过喂食管成功接受了维莫拉非尼/考比替尼治疗。测定了维莫非尼和考比替尼的血浆浓度。两名患者均观察到部分反应,但均经历了显著的毒性。结论我们的病例表明,维莫非尼/考比替尼治疗对 BRAF V600 突变甲状腺癌有效,即使通过饲管给药也是如此。虽然两名患者都出现了严重的副作用,但我们推测这不是由于给药途径造成的。因此,通过饲管给药维莫非尼/考比替尼是可行且有效的。试验注册临床试验标识:NCT02925234。
新闻发布
关于多西布替尼 (AS-1763) 多西布替尼是一种高选择性、口服生物利用度、野生型和突变型 BTK 的非共价抑制剂,用于治疗 CLL 和其他 B 细胞恶性肿瘤。包括依鲁替尼在内的共价 BTK 抑制剂是 B 细胞恶性肿瘤患者的主要治疗选择。然而,据报道,由于 BTK 中 481 位半胱氨酸残基被丝氨酸取代(C481S - 2 -突变),患者在治疗期间会产生耐药性,从而降低共价 BTK 抑制剂的疗效。此外,据报道,最近批准的非共价 BTK 抑制剂吡托布替尼出现了其他类型的耐药突变。多西布替尼可有效抑制野生型和突变型 BTK,这强烈表明多西布替尼将成为治疗具有野生型和耐药突变的 B 细胞恶性肿瘤患者的新治疗选择。 Carna 正在推进多西他替尼作为下一代 BTK 抑制剂的开发。多西他替尼的 1b 期研究正在美国进行,剂量扩展部分的给药于 2024 年 10 月开始。这项研究的初步数据由 MD Anderson 白血病科的 Nitin Jain 教授(医学博士,领导这项研究)于 2024 年 6 月在欧洲血液学协会 (EHA) 2024 混合大会上公布,数据显示,该药物在接受过包括共价 BTK 抑制剂和 BCL2 抑制剂在内的全身疗法治疗的 CLL 患者中具有良好的安全性和 PK 特征以及有希望的疗效。联系人:企业规划 Carna Biosciences, Inc. 电话:+81-78-302-7075 https://www.carnabio.com/english/