XiaoMi-AI文件搜索系统
World File Search SystemC-JUN的磷酸化状态和DNA结合活性取决于结合位点的细胞内浓度 第8卷31980核酸研究 受体结合的尿激酶与I型纤溶酶原激活剂抑制剂的可及性 胰岛素调节有丝分裂原激活的蛋白激酶激酶(MEK),有丝分裂原激活的蛋白激酶和酪蛋白激酶在细胞核中:Possibl gi-protein A大鼠大脑皮层中的亚基 协调人造血细胞中HOX基因的调节 在体内抑制tonb盒的tonb盒共识pentapeptide 中的甲基定向修复框架突变 CALF的DNA依赖性RNA聚合酶的合成...
基因选择性转录因子通过与其靶基因调节区域内的特定DNA元件结合(1)。但是,并非完全定义此DNA结合的序列要求。几个参数,例如蛋白质 - 蛋白质相互作用与相邻结合的因素,DNA结构的影响(弯曲等)。),重要的是,结合位点与认知因子的比率确定给定转录因子是否可以有效地与相应的结合位点相互作用。体外和大概也在体内也是如此,对于确定转录因子是否会与其最佳识别序列的变体结合,因此,它的基因调节。在这些考虑因素中提示,我们询问是否存在一种蜂窝机制,该机制是否存在在转录因子活动和可用目标位点的繁琐之间保持平衡。对AP-1家族成员的特征良好转录因子C-Jun进行了实验(2-4)。包含AP-1结合位点的启动子是C-Jun调节的目标。C-Jun的活性受到多种机制的紧密控制,并且对蛋白质的异常调节会导致恶性转化和致癌作用(5)。在这项研究中,我们描述了一种机制,该机制通过改变其磷酸化态的DNA结合活性,取决于细胞中存在的C-Jun结合位点的浓度。这种机制可以用来设置和微调C-Jun与其结合位点的比率。有趣的是,与这种现象有关的磷酸化位点与以前据报道经历信号依赖性去磷酸化相同。
Olaparib用于维持BRCA突变的维护处理 -
3.2当前,新诊断的BRCA突变阳性晚期卵巢癌没有一线维护治疗方案。通常通过手术和基于铂的化学疗法进行治疗,之后没有主动治疗。不幸的是,大多数人都会复发。Olaparib是一种多核糖(PARP)抑制剂。 可以在治疗途径的以后线上使用PARP抑制剂维护处理。 Olaparib作为一线维护治疗的可用性是管理BRCA突变阳性晚期卵巢癌的重要发展,因为预计早期使用时将具有最大的好处,并且如果在第一次复发之前给出了某些人的潜力。 委员会从一名患者专家那里听到的,该专家在手术后开始服用Olaparib治疗晚期卵巢癌和4行化学疗法。 她解释说,奥拉帕里布(Olaparib)对她有变革,延长了她的生命。 它使她能够过正常的生活,具有可管理的副作用,尤其是与化学疗法的副作用相比。 委员会听说奥拉帕里(Olaparib)在初步化疗后将是最有益的,当人们感觉仍然相对较好时,他们的身体更强大地应对任何副作用,并且有更大的治疗疾病的潜力。 委员会得出的结论是,基于一线铂金化疗后奥拉帕里的可用性代表了BRCA突变阳性晚期疾病的管理的重要发展,并且将受到患者和临床医生的高度重视。Olaparib是一种多核糖(PARP)抑制剂。可以在治疗途径的以后线上使用PARP抑制剂维护处理。Olaparib作为一线维护治疗的可用性是管理BRCA突变阳性晚期卵巢癌的重要发展,因为预计早期使用时将具有最大的好处,并且如果在第一次复发之前给出了某些人的潜力。委员会从一名患者专家那里听到的,该专家在手术后开始服用Olaparib治疗晚期卵巢癌和4行化学疗法。她解释说,奥拉帕里布(Olaparib)对她有变革,延长了她的生命。它使她能够过正常的生活,具有可管理的副作用,尤其是与化学疗法的副作用相比。委员会听说奥拉帕里(Olaparib)在初步化疗后将是最有益的,当人们感觉仍然相对较好时,他们的身体更强大地应对任何副作用,并且有更大的治疗疾病的潜力。委员会得出的结论是,基于一线铂金化疗后奥拉帕里的可用性代表了BRCA突变阳性晚期疾病的管理的重要发展,并且将受到患者和临床医生的高度重视。
通过 CRISPR 编辑鉴定出可提高胎儿血红蛋白表达的新型 HPFH 样突变
1 印度韦洛尔基督教医学院干细胞研究中心(班加罗尔 inStem 的一个单位);2 印度特里凡得琅 Sree Chitra Tirunal 医学科学与技术研究所;3 美国伯克利加州大学伯克利分校创新基因组学研究所;4 美国旧金山格拉德斯通研究所数据科学与生物技术研究所;5 澳大利亚悉尼新南威尔士大学生物技术与生物分子科学学院;6 印度卡纳塔克邦马尼帕尔高等教育学院;7 印度韦洛尔基督教医学院暨医院血液学系;8 日本茨城县理化学研究所生物资源中心细胞工程部;9 日本红十字会中央血液研究所血液服务总部研究与开发部,日本东京;10 印度韦洛尔基督教医学院生物化学系; 11 加州大学洛杉矶分校微生物学、免疫学和分子遗传学系,美国洛杉矶;12 瑞士苏黎世生物系分子健康科学研究所
引用Chen X,Wang Z,Fu W,Wei Z,Gu J,Wang C,Zhang Z,Yu X,Yu X和Hu W(2025)由Clcn7突变引起的骨质造影的代谢组学研究揭示了
骨质骨术是一种罕见的代谢骨疾病,其特征是骨矿物质密度异常增加,导致骨髓衰竭,压缩神经病和骨骼畸形(1)。根据遗传模式,可以将其分为常染色体显性骨质术(ADO),常染色体隐性骨质骨术(ARO)和X连接的骨质疏松症(XLO)(1-3)。ADO是骨质骨术的最常见形式,估计发病率为1:20,000(4)。早期,ADO被认为包括两种表型,ADO I(OMIM 607634)和ADO II(OMIM 166600)(2)。ADO I的特征是LDL受体相关蛋白5(LRP5)基因的突变,该基因导致高骨量,但不会导致骨折(5)。ADO II是由整骨骨吸收受损引起的,这些骨吸收通常是由于氯化物通道7(CLCN7)基因(6,7)中杂合的错义突变引起的。clcn7是一种基因,不仅可以引起严重的隐性骨质肌膜病形式,即ARO,而且还可以根据Clcn7突变的类型(8)。此外,由CLCN7突变引起的ADO II占ADO的70%,这是最常见的骨质疏松症类型(9)。因此,这项研究的重点是由CLCN7突变引起的骨质疏松症。CLCN7编码Cl- /H +交换转运蛋白7,也称为CLC-7,通常将其定位于溶酶体区室和骨 - 分解骨细胞的Ruf膜膜(10)。CLCN7突变导致骨质细胞异常无法分泌酸,因此无法溶解骨骼,从而导致骨质疏松症。这种疾病表现出异质性,表型表现出各种程度的严重程度,从无症状到威胁生命(11-13)。在没有基因检测或典型的放射线摄影发现的情况下,乳酸脱氢酶(LDH),天冬氨酸氨基转移酶(AST)和肌酸激酶BB同酶(CK-BB)的水平升高与Clcn7突变引起的骨化(14、15)有关。尽管如此,这些生物标志物的水平尚未证明与疾病的严重程度相关,而正常值不排除CLCN7基因中突变的存在(4)。因此,迫切需要找到更多的特定和敏感的生物标志物。有许多关于骨质造成症的遗传研究,但目前尚未发现CLCN7突变引起的骨质疏松症的血清代谢研究。通过阐明区分健康和疾病表型的特定特征,代谢组已成为理解生理和病理过程之间差异的基石,可能使我们可以搜索
通过针对顺式调控元件突变的 FIND-IT 筛选优化大麦植酸酶基因表达
结果与讨论:发现了基因表达较高或较低的突变体,最终成熟谷物植酸酶活性 (MGPA) 较高或较低。田间试验和发芽期间的肌醇磷酸分析表明,PAPhy_a 不会影响试验条件下的农艺性能,但它确实缩短了发芽期间磷酸盐动员的滞后时间。较高的内源性 MGPA 可提高饲料用谷物质量,因为它可提高单胃动物的磷酸盐生物利用度。此外,由于 PAPhy_a 启动子的目标 CRE 基序与一系列种子表达基因(如关键的谷物和豆类储存基因)共享,因此当前结果展示了一种调节一系列种子基因的单个基因表达水平的概念。
osimertinib用于未处理的EGFR突变阳性非...
先进或转移性EGFR突变阳性NSCLC首先用EGFR酪氨酸激酶抑制剂(例如Afatinib,Gefitinib或Erlotinib)处理,并符合对Afatinib,Gefitinib,Gefitinib和Erlotinib的好指导。临床专家解释说,通常会根据临床证据提供Afatinib(请参阅第3.4节)。在Afatinib,Gefitinib或Erlotinib之后,如果Osimertinib在EGFR Gene中开发了T790M的耐药性突变(符合NICE的技术评估指南,则可以为Osimertinib提供T790M的抵抗突变,以治疗EGFR T790M突变阳性的NSCLC,或者如果不是Chems,或者没有)。不足以进一步治疗的人将获得最佳的支持护理。化学疗法后,可以提供免疫疗法,有或不带有候选结的多西他赛或最佳支持护理。临床专家表示,奥西替尼将作为另一种治疗选择是有益的,因为它比现有的
达拉非尼联合曲美替尼治疗 1 岁及以上儿童和青少年的 BRAF V600E 突变阳性胶质瘤
3.1 神经胶质瘤是儿童和年轻人中最常见的脑癌类型。它们由支持大脑和脊髓神经细胞的神经胶质细胞发展而来。神经胶质瘤根据其生长速度进行分类。大多数神经胶质瘤为 1 级或 2 级,称为低级别神经胶质瘤 (LGG),不生长或仅生长缓慢。3 级和 4 级神经胶质瘤称为高级别神经胶质瘤 (HGG),生长迅速。因此,HGG 的结果比 LGG 更差。BRAF 是一种编码蛋白质 B-Raf 的基因,它会影响细胞生长。BRAF V600E 突变阳性的 LGG 患者的寿命比没有突变的神经胶质瘤患者短。患者专家强调了神经胶质瘤诊断对儿童和年轻人、他们的家人和照顾者的创伤性,以及当前治疗的局限性。他们指出,神经胶质瘤及其治疗可能会延迟教育、限制社交,并导致持久的情绪
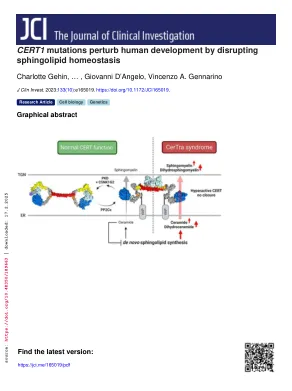
CERT1 突变通过破坏鞘脂稳态来扰乱人类发育
Charlotte Gehin, 1 Museer A. Lone, 2 Winston Lee, 3,4 Laura Capolupo, 1 Sylvia Ho, 1 Adekemi M. Adeyemi, 5 Erica H. Gerkes, 6 Alexander PA Stegmann, 7 Estrella López-Martín, 8 Eva Bermejo-Sánchez, 8 Martínez, Martínez, Dzierz , 9,10 Cornelia Kraus, 9 Bernt Popp, 11,12 Vincent Strehlow, 11 Daniel Gräfe, 13 Ina Knerr, 14,15 Eppie R. Jones, 16 Stefano Zamuner, 17 Luciano A. Abriata, 18 Vidya Kunnathully, 1 19 Anthony Eller, Samuel Anthony, 1. 21 Jean-Philippe Bocquete, 21 Evelyne Ruchti, 22 Greta Limoni, 22 Marine Van Campenhoudt, 22 Samuel Bourgeat, 22 Petra Henklein, 23 Christian Gilissen, 24,25 Bregje W. van Bon, 24 Rolph Pfundt, 25 Landa, 24 Jole, H. H. Schemjole. 26 Emanuela Leonardi, 27,28 Fiorenza Soli, 29 Alessandra Murgia, 28 Hui Guo, 30 Qiumeng Zhang, 30 Kun Xia, 30 Christina R. Fagerberg, 31 Christoph P. Beier, 31 Martin J. Larsen, 31 Irene Xienzu, 32 Fernando Valyinda , 33 Robert Śmigiel, 34 Vanesa López-González, 35 Lluís Armengol, 36 Manuela Morleo, 37,38 Angelo Selicorni, 39 Annalaura Torella, 37,38 Moira Blyth, 40 Nicola S. Cooper, 41 Vare Wilson, 44, 434 ore Garde, 45,46 Ange-Line Bruel, 46,47 Frederic Tran Mau-Them, 46,47 Alexis BR Maddocks, 48 Jennifer M. Bain, 49 Musadiq A. Bhat, 50 Gregory Costain, 51 Peter Kannu, 52 Ashish Marwaha, 51 Michael E. E. Friegne, 35 B. Richardson, 53 Vykuntaraju K. Gowda, 54 Varunvenkat M. Srinivasan, 54 Yask Gupta, 55 Tze Y. Lim, 55 Simone Sanna-Cherchi, 55 Bruno Lemaitre, 21 Toshiyuki Yamaji, 56 Kentaro Hanada, 56 John E. Burke, 2017, Ana Briš , D. McCa . abe, 22 Paolo De Los Rios, 1,17 Thorsten Hornemann, 2 Giovanni D'Angelo, 1,19,21 and Vincenzo A. Gennarino 3,58,59,60,61
带有白血病相关基因突变的血液可能导致心肌梗塞和脑损伤……
Shuhei Koide,Tamami Denda,小刘,Koji Ueda,Keita Yamamoto,Shuhei Asada,Reina takeda,Taishi Yonezawa,Taishi Yonezawa,Taishi Yonezawa,田纳克州Yosuke,田纳克,esteban masuda,atsushi iwama,Hitoshi Shimano,Jun-Ichiro inoue,Kensuke Miyake和Toshio Kitamura* doi:10.1038/s44161-024-00579-w url: :授予科学研究的补助金(授予号:20H00537),授予创新领域的科学研究(授予:19H04756)和授予科学研究的赠款(授予号)这项工作得到了日本血液学会 (编号 19H03685) 的资助。 术语注释1: 克隆性造血(CH):具有遗传异常的血细胞克隆性增殖的状态。
viperin突变与斑马鱼中VHSV感染期间的免疫,免疫细胞动力学和代谢改变有关
耐粘蛋白是在动物中发现的突出的抗病毒蛋白。耐蛋白的主要功能是生产3'-deoxy -3',4' - 二维德罗 - 酪氨酸三磷酸(DDHCTP),这是一种参与病毒RNA合成的抑制性核苷酸。哺乳动物模型中的研究表明,DDHCTP会干扰代谢蛋白。但是,该假设尚未在Telest中进行检验。在这项研究中,测试了耐毒素在调节病毒出血性败血病毒(VHSV)感染中的代谢改变中的作用。被VHSV感染时,viperin - / - 鱼的死亡率较高。vhsv拷贝数和NP基因的表达在耐蛋白 - / - 芬中显着增加。代谢基因分析显示,苏打,HIF1A,FASN和ACC表达的显着差异,表明它们对代谢的影响。在VHSV感染期间,斑马鱼幼虫中的胆固醇分析表明,胆固醇的产生显着上调,没有耐耐蛋白。对ZF4细胞的体外分析表明,脂质产生的降低显着降低,并且具有耐毒素过表达的活性氧(ROS)产生的显着上调。中性粒细胞和巨噬细胞的募集显着调节。因此,我们证明了耐蛋白在干扰VHSV感染过程中的代谢改变中起作用。