XiaoMi-AI文件搜索系统
World File Search System199 S phase S期细胞周期中DNA合成开始的阶段。 S1 ...
sex chromosome 性染色体 决定个体性别的染色体。对于所有的哺 乳动物,小部分开花植物和大多数昆 虫,它们的雌性个体都携带一对 X 染色 体,而雄性个体携带一条 X 和一条 Y 染色 体。对于鸟类,爬行动物和绝大多数两 栖动物,雄性个体都携带一对W染色体, 雌性携带一个 W 和一个 Z 染色体。一些昆 虫中只有一种X染色体,其数量的多少决 定昆虫的性别。同义词: 异染色体 ( allo some )反义词: 常染色体 ( autosome )。
针对乳腺癌细胞周期:CDK4/6抑制剂
摘要:通过细胞周期D / CDK / PRB途径的细胞周期放松管制在乳腺癌贷款支持中经常观察到针对细胞周期控制机制的药物的发展,例如环素依赖性激酶(CDK)4和6。到目前为止,FDA批准了三个CDK4 / 6抑制剂,用于治疗激素受体阳性(HR +),HER2阴性转移性乳腺癌。这些药物在改善临床结果方面具有有效的作用,但是固有或获得的耐药性的发展可以限制这些治疗方法的效率。临床和转化研究现在侧重于研究CDK4 / 6抑制和新型治疗策略的敏感性 /抗性机制,旨在改善临床结果。本评论总结了有关CDK4 / 6抑制剂的可用知识,发现新的反应生物标志物以及新的治疗组合策略的生物学原理。
细胞周期或细胞分段周期是
接受罗伯特·雷姆克(Robert Remak)的工作,他表现出细胞的起源是现有细胞的分裂。在1855年,他出版了Remak的作品为自己的“ Omnis Cellula e Cellula,Id est” - 来自细胞的所有细胞(Come)(epigram实际上是由François -Vincent Raspail创造的,但由Virchow推广)
pold1是细胞周期进展所必需的
摘要。背景/目标:由于缺乏有效的治疗靶标,恶性胸皮瘤(MPM)患者的预后仍然很差。长期暴露于石棉纤维引起的DNA损伤与MPM的发展有关,在编码DNA损伤修复(DDR)相关的分子的基因上发生突变,在MPM患者中经常表达。本研究旨在使用大型公共数据库(例如Cancer Genome Atlas(TCGA)(TCGA)和基因型组织表达项目(GTEX)鉴定MPM中的新型治疗靶标(GTEX)。材料和方法:在TCGA间皮瘤(TCGA-MESO)数据集中,在间皮瘤患者中分析了与DDR相关基因的mRNA表达水平与总生存率(OS)之间的相关性。随后在MPM细胞系中测试了小型干扰RNA(siRNA)对与OS相关的DDR相关基因的抗肿瘤作用。结果:高水平编码DNA聚合酶三角洲1,催化亚基(POLD1)的mRNA与MPM患者的OS降低显着相关(P <0.001,对数秩检验)。此外,靶向POLD1(SIPOLD1)的siRNA在G 1 /S检查点引起细胞周期停滞,并诱导凋亡,涉及MPM细胞系中DNA损伤积累的凋亡。结论:POLD1在MPM细胞中G 1 /S检查点上克服DNA损伤和细胞周期进程中起着至关重要的作用。这些发现表明Pold1可能是MPM中新型的治疗靶标。
人脑膜瘤细胞对细胞周期蛋白的敏感性 -
大脑的连通性是局部密集且全球稀疏的,形成了一个小世界图,这是各种物种进化中普遍存在的原理,为有效的信息路由提供了通用解决方案。但是,当前的人工神经网络电路架构并不能完全包含小世界的神经网络模型。在这里,我们介绍了神经形态的镶嵌:一种非冯·诺伊曼收缩期架构,采用分布式备忘录来进行内存计算和内存路由,有效地实现了用于尖峰神经网络(SNNS)的小世界图形拓扑。我们使用具有130 nm CMOS技术的集成的备忘录,设计,制造和实验证明了马赛克的构建块。我们表明,由于在连接性中执行局部性,马赛克的路由效率至少比其他SNN硬件平台高一个数量级。这是Mosaic在各种边缘基准中实现竞争精度的同时。Mosaic为基于分布式尖峰的计算和内存路由的边缘系统提供了可扩展的方法。
针对细胞周期依赖性激酶治疗肉瘤
晚期/转移性骨和软组织肉瘤的有效治疗仍代表着尚未得到满足的医疗需求。靶向治疗的最新进展凸显了细胞周期依赖性激酶 (CDK) 抑制剂在包括肉瘤在内的多种癌症类型中的潜力。CDK 是细胞周期的主要调节器;它们的失调被列为“癌症标志”,而肉瘤也不例外。在这篇综述中,我们报告了 CDK 抑制剂在肉瘤治疗中的分子基础和潜在治疗意义。此外,我们描述并讨论了与传统治疗、靶向治疗和免疫治疗联合治疗的可能性和生物学原理,强调了未来研究将 CDK 抑制整合到肉瘤治疗中的潜在途径。
第2章染色体,细胞周期和细胞分裂的结构
(b)中心体是细胞中产生微管的区域。在动物细胞中心体内,有一对称为中心元的小细胞器。在动物细胞分裂期间,中心体划分和中心元素复制(制作新副本),而其凝结形式的每种染色体都由沿着长度的某个点结合的两个染色单体组成。此依恋点称为Centromere。
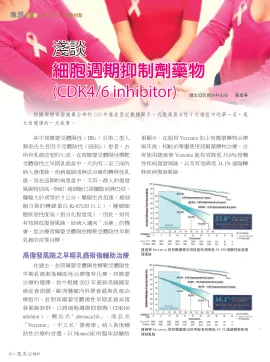
浅谈细胞周期抑制剂药物(CDK4/6抑制剂)
2.Matthew P. Goetz,Masakazu Toi等。Monarch 3:Abemaciclib作为晚期乳腺癌临床肿瘤学杂志的初始疗法。2017; 35(32); 3638-3646 3.George W. Sledge,Jr。,Masakazu Toi等。MONARCH 2:ABEMACICLIB与HR+/HER2-晚期乳腺癌女性的Abemaciclib结合使用,她在接受内分泌疗法杂志临床肿瘤学杂志时进展。2017; 35(25); 2875-2884 4.Maura N. Dickler,Sara M. Tolaney等。Monarch 1,Abemaciclib,CDK4和CDK6抑制剂的II期研究,作为一种药物,对难治性HR+/HER2-转移性乳腺癌临床癌症研究的患者。2017; 23(17); 5218-5224
1 人类脑膜瘤细胞对细胞周期蛋白的敏感性......
最初发表于:von Achenbach, Caroline;Le Rhun, Emilie;Sahm, Felix;Wang, Sophie S;Sievers, Philipp;Neidert, Marian C;Rushing, Elisabeth J;Lawhon, Tracy;Schneider, Hannah;von Deimling, Andreas;Weller, Michael (2020)。人类脑膜瘤细胞对细胞周期依赖性激酶抑制剂 TG02 的敏感性。转化肿瘤学,13(12):100852。DOI:https://doi.org/10.1016/j.tranon.2020.100852
细胞周期抑制剂激活缺氧诱导的DDX41 ...
引言肝细胞癌(HCC)是世界上第六个最常见的癌症,也是全球癌症死亡率的第三个常见原因(1)。细胞周期扰动通常与癌发生和恶性转化有关,并且是癌症的已知特征(2,3)。化学疗法是通过通过细胞毒性或靶向方式诱导程序性细胞死亡来治疗癌症超过50年的方法之一(4)。The classical cytotoxic therapies involve the use of paclitaxel (microtubule stabilizer) and palbociclib (cyclin-dependent kinase [CDK] 4 and 6 inhibitor), which have been approved by FDA for treating ovarian car- cinoma, breast carcinoma, non–small cell lung carcinoma, AIDS-related Kaposi's sarcoma (5) ,和乳房cer(6)。然而,它们对HCC的影响仍然尚不清楚,因为它们仍在II期临床试验中(紫杉醇对Palbociclib的NCT02423239和NCT04175912)(NCT01356628)。其他细胞周期抑制剂,例如Aurora激酶抑制剂(GSK1070916和AZD1152),现在正在进行临床试验,并被研究为潜在疗法(7)。然而,一些研究表明,HCC对紫杉醇建立了抵抗力(8,9),而II期临床研究表明,紫杉醇对HCC患者没有任何生存优势(10)。此外,终止了AZD1152的3项AZD1152的3个临床试验,因为AZD1152单一疗法的疗效不足以支持研究的连续性(NCT00497679,NCT00338182,and NCT00497731),这表明该细胞循环不可能是有益的。单一疗法