XiaoMi-AI文件搜索系统
World File Search System直接体内汽车T细胞工程
t细胞修饰以表达智能设计的嵌合抗原受体(CAR)是复发和难治性血液癌的异常强大的治疗剂,并且有可能彻底改变许多其他疾病的治疗。为了避免与过大规模生产的收养细胞治疗产品的广泛构成相关的复杂性和成本,这是通过直接输注纳米颗粒配方核酸或工程性病毒载体在过去几年中引起了很大的关注,从而在体内产生Car T细胞的替代策略。在这里,我们概述了离体制造过程是直接体内策略的激励框架,并讨论了从临床前模型的新兴数据,以突出体内方法的效力,适用于新疾病适应症以及与临床准备的剩余挑战,包括临床准备就绪,包括交付特定的特定期限,长期延期效率。
B 细胞工程——一种有前途的疫苗方法......
全球病例数已超过六百万(死亡人数超过三十七万),迫切需要研制出针对 SARS-CoV-2 疾病 (COVID-19) 的疫苗(并重新利用药物)。可以说,疫苗可能是遏制这种疾病传播和预防其未来发生的最有效方法。尽管人们正在做出许多尝试来设计和开发 SARS-CoV-2 疫苗,但确实存在相关的技术障碍。这也许是我们没有针对冠状病毒(包括 SARS-CoV-1 和 MERS)疫苗的原因之一。除了(而不是)纠正基因组的缺陷部分之外,最近开发的 CRISPR 介导的基因组编辑方法还可以重新用于细胞改造。在此前提下,B 细胞可以被设计成通用供体、抗原特异性、永久存活、持久、非致癌、相对良性的抗体产生细胞,可作为 SARS-CoV-2 的有效疫苗,并且出于同样的原因,也可作为其他病毒和病原体的有效疫苗。
宾夕法尼亚大学系统免疫学和细胞工程博士后职位
宾夕法尼亚大学综合免疫学和细胞设计实验室正在招募博士后研究员加入我们不断壮大且充满活力的团队。我们的研究整合了高通量 T 细胞抗原发现( TScan-I 、 TScan-II 、 TCR-MAP )、单细胞基因组学和合成生物学,以揭示 T 细胞如何识别和响应自身免疫、癌症和传染病中的自身和外来抗原。我们开创了基因组规模的抗原发现平台( Cell 2019 、 Cell 2023 、 Nature Biotechnology 2024 ),阐明了免疫反应的关键抗原驱动因素。在此基础上,我们寻求扩展这些平台并将它们与先进的免疫基因组学和蛋白质组学工具相结合,以全面绘制 B 细胞和 T 细胞的抗原图谱。我们的最终目标是确定免疫识别和耐受的分子决定因素,从而确定自身免疫、癌症和传染病的新治疗靶点。
利用包膜递送载体进行体内人类 T 细胞工程
病毒和病毒衍生颗粒具有将分子递送至细胞的内在能力,但难以轻易改变细胞类型选择性,这阻碍了它们用于治疗递送。本文,我们展示了通过包裹 CRISPR-Cas9 蛋白和向导 RNA 的膜衍生颗粒上展示的抗体片段识别细胞表面标志物,可以将基因组编辑工具递送至特定细胞。与依赖进化的衣壳向性递送病毒编码货物的传统载体(如腺相关病毒)相比,这些 Cas9 包装包膜递送载体 (Cas9-EDV) 利用可预测的抗体-抗原相互作用将基因组编辑机制选择性地暂时递送至目标细胞。抗体靶向的 Cas9-EDV 优先在混合群体中的同源靶细胞中而不是旁观者细胞中进行基因组编辑,无论是体外还是体内。 Cas9-EDV 使用多重靶向分子直接递送至人类 T 细胞,能够在人源化小鼠中生成基因组编辑的嵌合抗原受体 T 细胞,从而建立一种可编程的递送方式,具有广泛治疗用途的潜力。
通过靶向的脂质纳米颗粒在体内mRNA CAR T细胞工程,肝外向主义
在食品药物协会批准的六种疗法中,嵌合抗原受体(CAR)T细胞具有重塑癌症免疫疗法。然而,这些疗法依赖于离体病毒转导来诱导T细胞中的永久性CAR表达,这有助于高生产成本和长期侧面影响。因此,这项工作旨在开发一个体内CAR T细胞工程平台,以使用mRNA诱导瞬时可调的汽车表达。特别是使用电离脂质纳米颗粒(LNP),因为这些平台在核酸递送方面已显示出临床成功。尽管LNP经常积聚在肝脏中,但此处使用的LNP平台可通过增强向脾脏的递送来实现肝外转染,并通过抗体偶联(AB-LNP)进一步修改以靶向Pan-T细胞标记。对这些AB-LNP的体内评估,即对有效的T细胞转染必需的靶向。使用这些AB-LNP用于递送CAR mRNA,抗体和剂量依赖性的CAR表达和细胞因子释放,而B细胞的耗竭最高为90%。总的来说,这项工作将抗LNP的抗体与肝外向主义相结合,评估Pan-T细胞标记物,并开发能够在体内产生功能性CAR T细胞的AB-LNP。
Antion Biosciences 宣布在欧洲基因和细胞治疗学会上发表其多重细胞工程平台的两篇摘要
“我们非常高兴能够展示迄今为止我们生成的一些最令人兴奋的数据——我们不仅能够对 CAR-T 细胞进行多重工程改造,超越基因编辑技术的能力,而且我们还开始展示具体的功能数据和可调节 HLA-I 沉默的原理,”首席执行官 Marco Alessandrini 博士说道。“Antion 致力于通过采用我们极其通用的技术套件来突破细胞治疗的极限。我们欢迎所有与会者在海报展示期间加入我们,以了解有关我们进展的更多信息,并探索我们的技术在细胞和基因治疗领域的潜在应用。”
https://doi.org/10.1038/s41551-024-01245-z 文章通过体外和原位环化 RNA 实现稳健的基因组和细胞工程
环化可以提高 RNA 的持久性,但缺乏简单且可扩展的方法来实现这一点。在这里,我们报告了两种有助于寻找环状 RNA (cRNA) 的方法:使用 II 组内含子通过体外环化开发的 cRNA,以及通过普遍表达的 RtcB 蛋白通过细胞内环化开发的 cRNA。我们还报告了简单的纯化方案,可实现高 cRNA 产量 (40-75%),同时保持低免疫反应。这些方法和方案促进了干细胞工程的广泛应用,以及通过锌指蛋白和 CRISPR-Cas9 实现强大的基因组和表观基因组靶向。值得注意的是,与心肌细胞和神经元中的线性加帽 RNA 相比,带有脑心肌炎内部核糖体进入的 cRNA 能够实现强大的表达和持久性,这突出了 cRNA 在这些非分裂细胞中的效用。我们还描述了通过以 cRNA 形式递送的去免疫 Cas9 进行基因组靶向,以及用于组合筛选去免疫蛋白质变体的远程多路复用蛋白质工程方法,该方法使 cRNA 递送蛋白质的表达持久性和免疫原性之间能够兼容。cRNA 工具集将有助于治疗学的研究和开发。
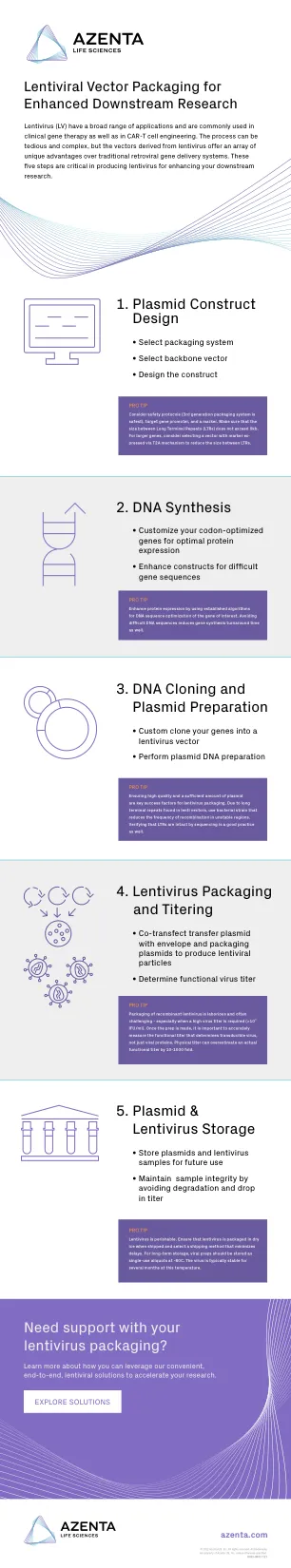
1. 质粒构建体设计 2. DNA 合成 3. ...
慢病毒 (LV) 具有广泛的应用,常用于临床基因治疗以及 CAR-T 细胞工程。该过程可能繁琐而复杂,但慢病毒载体与传统逆转录病毒基因递送系统相比具有一系列独特优势。这五个步骤对于生产慢病毒以增强您的下游研究至关重要。
髓系细胞介导的药物输送
在组织炎症、损伤或癌症存在的情况下,髓系细胞通过涉及骨髓生成、趋化性、细胞迁移和细胞渗出等多步骤过程被募集到疾病区域。作为一种新兴的药物输送方法,细胞介导的药物输送利用细胞募集过程来增强治疗物质向疾病区域的主动运输。在过去的几十年中,出现了各种纳米工程方法来增强纳米颗粒与目标细胞的相互作用,这些方法可以适用于细胞介导的药物输送。此外,药物输送领域可以从最近基于细胞的疗法的临床成功中受益,这种疗法创造了细胞工程方法来设计循环白细胞作为“活体药物输送载体”来靶向患病组织。在这篇综述中,我们首先概述了髓系细胞募集,并讨论了该过程中的各种因素如何影响细胞介导的输送。在这篇评论文章的第二部分,我们总结了纳米工程和细胞工程方法的现状,并讨论了如何将这些工程方法应用于细胞介导的递送。最后,我们讨论了该领域的未来方向,指出了细胞介导药物递送临床转化中的关键挑战。由 Elsevier BV 出版
新兴字段
efp 45设计先进的TCR-T细胞根除骨肉瘤项目负责人:Dietmar Rieder大学 /研究地点:生物信息学研究所,Innsbruck Biocenter Innsbruck,Innsbruck,Innsbruck,Intrain 80-82,6020 Intsbruck,Intsbruck,Intsbruck,Outhiria Lifemile:01.10.10.10.10.2024-2029。医学理论科学,药房(50%);医学工程(20%)关键词:癌症免疫疗法,TCR-T细胞,小儿骨肉瘤,T细胞工程,CRISPR/CAS9筛选,单细胞多摩变