XiaoMi-AI文件搜索系统
World File Search System与JAK/Stat信号通路有关的精子干细胞的细胞功能
本手稿全面回顾了精子干细胞(SSC)和JAK/STAT信号通路之间的相互关系。男性哺乳动物睾丸中的精子干细胞,其特征在于其自我再生和多能分化能力,对于组织再生,免疫调节和再生医学的进步至关重要。本评论深入研究了SSC的历史背景和生物学特征,特别着重于JAK/STAT信号通路在其增殖,成熟和分化过程中的关键作用。研究表明,JAK/STAT途径广泛影响精子干细胞的各种功能,包括免疫调节,组织分化,归巢和对微环境的适应性。在此,我们对相关研究进行了整理和剖析,阐明了SSC和JAK/STAT信号通路之间的复杂动力学,并检查了这些相互作用对SSC的生物学属性和功能的含义。此外,审查讨论了这些发现对临床前研究和细胞工程领域的深刻含义。人们承认,尽管SSC的研究和JAK/STAT信号途径进行了进步,但对人类和较大哺乳动物的调查仍然不足,需要更深入的探索来建立一个全面的理论框架。总的来说,这篇综述提供了一个宝贵的参考,用于解密精子干细胞信号通路的机制,并为相关的临床前研究建立了理论基础。
针对 CAR-T 的疾病特异性 T 细胞体内工程改造
体内细胞工程通过直接控制体内细胞功能来增强 T 细胞免疫力,从而彻底改变了免疫疗法。这种方法绕过了目前工程细胞疗法(例如用抗癌嵌合抗原受体 (CAR) 修饰的 T 细胞)所需的复杂且昂贵的体外制造过程。然而,目前体内工程 T 细胞的方法依赖于泛 T 细胞标记(例如 CD3、CD8)来靶向 T 细胞,这可能导致与非选择性激活或抑制 T 细胞免疫相关的不良影响。在本次演讲中,我将首先介绍一种基因传递系统,称为抗原呈递纳米颗粒 (APN),它可以通过 mRNA 传递选择性地在体内工程化疾病抗原特异性 T 细胞。然后,我将展示如何设计 APN 以选择性地消耗自身反应性 T 细胞,以防止小鼠模型中 1 型糖尿病的发作。此外,我将展示如何使用 APN 将流感特异性 T 细胞重新编程为抗癌 CAR T 细胞,这种细胞在人类多发性骨髓瘤异种移植小鼠模型中取得了与病毒转导的体外 CAR 相当的治疗效果。在本次研讨会结束时,我将概述我未来实验室将采取的研究方向,即在体内设计细胞以进行抗原特异性免疫治疗、疾病检测和肿瘤重新编程。
生物学学院的新闻版本。白俄罗斯人 div>
白俄罗斯的植物和植被;景观设计基础的花卉培养;药植物;养生;真菌学植物病理学;原核生物的主要群体;分子生物学的基本原理;抗菌药物;医学微生物学;微生物细胞的外肌体遗传结构;工业微生物学;分子细菌学;应用免疫学;遗传过程的分子机制;亲核和真核生物的代谢调节;白俄罗斯的动物;动物地理学;寄生虫学;昆虫学;动物的种群生态;景观生态学;光合作用;植物的矿物喂养;生态植物生理;电生理学;细胞间交流的生理学;自主神经系统;比较生理学;细胞生理的基础知识;促和真核生物的分子遗传学;植物的生物技术;人类遗传学;遗传分析;内分泌学;生态生物化学;辐射生物化学;生物能学;细胞培养;向量系统;生物传感器系统;工程酶学;细胞工程;固定的细胞和酶;免疫酶学分析;生物技术生产的生产者;应用生态学;水生生物学;人类生态学;生理生态学;环境质量的生物指标;物理地理;化学生态学;白俄罗斯的生态问题;生态监测,控制和检查;放射科学;酵母分子生物学;基因组学;蛋白质组学;生物信号的分子基础;抗氧化剂系统功能的分子基础;酶学;植物和生物安全的生物工程;药理等。
同时抑制DNA-PK和Polϴ提高基因组编辑的整合效率和精度
3 数据科学与定量生物学、Discovery Sciences、生物制药研发、阿斯利康、英国剑桥 4 细胞分析开发、Discovery Sciences、生物制药研发、阿斯利康、瑞典哥德堡 5 细胞工程、Discovery Sciences、生物制药研发、阿斯利康、瑞典哥德堡 6 Promega Corporation、美国威斯康星州麦迪逊 7 转化基因组学、Discovery Sciences、生物制药研发、阿斯利康、瑞典哥德堡 8 转化科学与实验医学、研究与早期开发、呼吸与免疫学 (R&I)、生物制药研发、阿斯利康、瑞典哥德堡 9 细胞生物学与免疫学、Discovery Sciences、生物制药研发、阿斯利康、英国剑桥 10 数据科学与定量生物学、Discovery Sciences、生物制药研发部,阿斯利康,瑞典哥德堡 11 化合物合成与管理,Discovery Sciences,生物制药研发部,阿斯利康,瑞典哥德堡 43150 12 分子人工智能,Discovery Sciences,生物制药研发部,阿斯利康,瑞典哥德堡 13 Discovery Sciences,生物制药研发部,阿斯利康,英国剑桥 14 早期 TDE 发现,肿瘤学研发部,阿斯利康,英国剑桥 * 通讯联系人:电子邮件:marcello.maresca@astrazeneca.com 通讯也可寄给 Sandra Wimberger。电子邮件:sandra.wimberger@astrazeneca.com
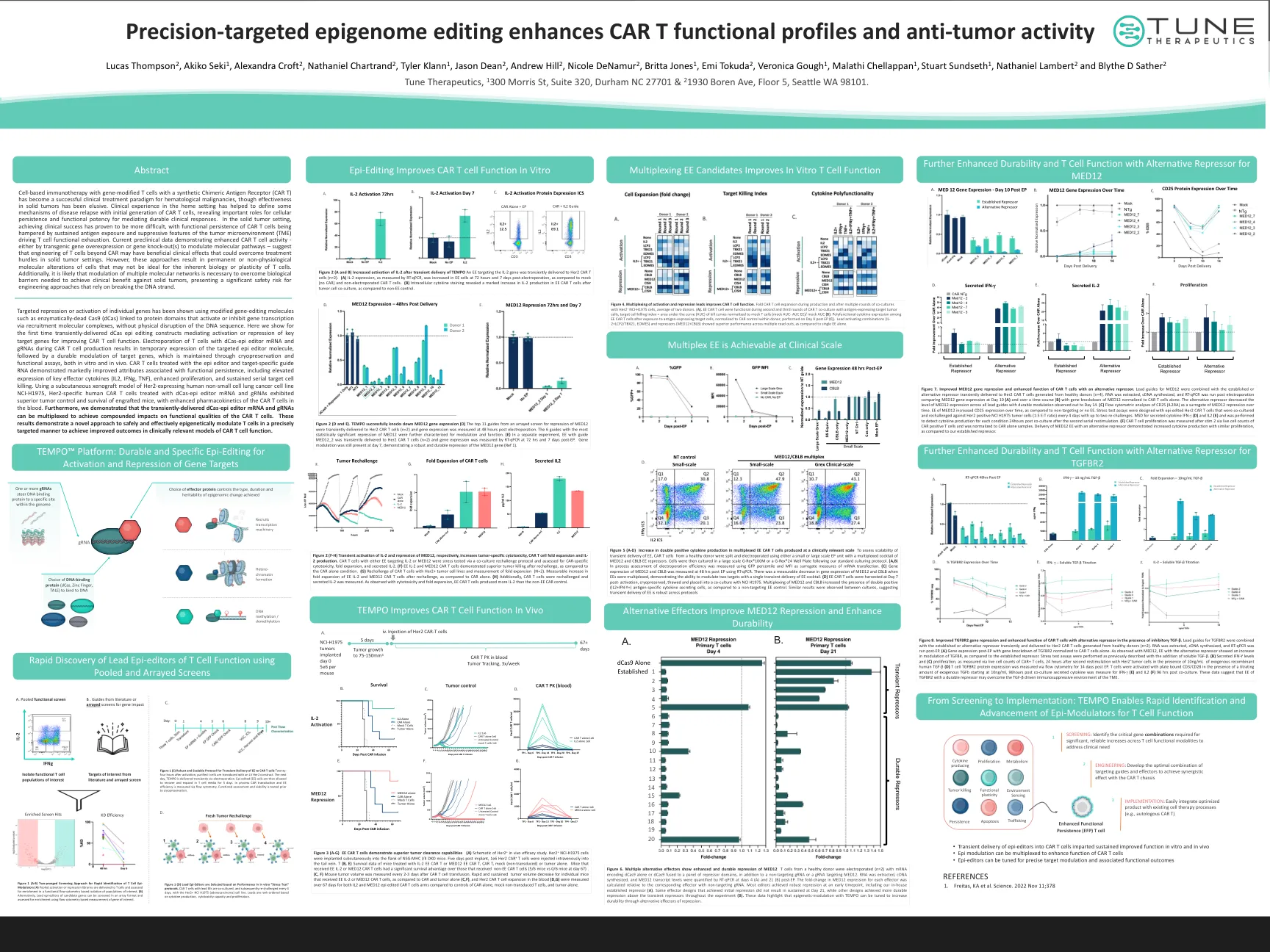
精准靶向表观基因组编辑增强 CAR-T...
使用合成嵌合抗原受体 (CAR T) 的基因修饰 T 细胞的细胞免疫疗法已成为血液系统恶性肿瘤的成功临床治疗范例,尽管其对实体瘤的有效性尚不清楚。在血液环境中的临床经验有助于确定 CAR T 细胞最初生成时疾病复发的一些机制,揭示了细胞持久性和功能效力在介导持久临床反应方面的重要作用。在实体瘤环境中,临床成功已证明更加困难,因为持续的抗原暴露和肿瘤微环境 (TME) 的抑制特征阻碍了 CAR T 细胞的功能持久性,导致 T 细胞功能衰竭。目前的临床前数据显示 CAR T 细胞活性增强 - 无论是通过转基因基因过度表达还是基因敲除来调节分子通路 - 表明,除了 CAR 之外的 T 细胞工程可能具有有益的临床效果,可以克服实体瘤环境中的治疗障碍。然而,这些方法会导致细胞发生永久性或非生理性的分子改变,这可能不利于 T 细胞固有的生物学或可塑性。此外,可能需要调节多个分子网络才能克服实现针对实体肿瘤的临床益处所需的生物屏障,这对依赖于破坏 DNA 链的工程方法而言具有重大的安全风险。
使用CRE/LOXP重组系统靶向基因整合到微藻的核基因组
抽象的遗传修饰的微藻被认为是生物能源和重组蛋白质产生的有用工具。然而,微藻核基因组中转基因的随机整合易受异源基因表达的基因沉默。在这里,我们试图使用CRE/ LOXP重组系统进行稳定的转基因表达,将靶向基因整合到雷目层的预定的核基因组位点中。我们构建了一个表达载体质粒编码报告基因(Zeocin耐药基因和绿色荧光蛋白基因; ZEO-2A-GFP)和突变的LOXP来产生创建者细胞。构建了编码IFNα-4的供体载体和抗性霉素的抗性基因,构造了相应突变的LOXP S,并与CRE表达载体一起构建并引入创始人细胞。通过计算抗霉素抗性菌落的数量来确定供体载体与CRE表达载体的最佳比率。对于已建立的克隆,使用各种特定引物集通过基因组PCR确认了靶向积分。供体载体中的靶基因可以使用CRE/ LOXP系统整合到Reinhardtii的预期基因组位点中。rt-PCR表明,IFNα-4在测试的五个独立的转基因细胞系中表达。该结果表明,基于CRE的细胞工程是一种产生表达外源基因的智能微藻的有前途的方法。
Gelofusine作为洗涤的dextran40的替代品...
1纽约州纽约的纪念斯隆·凯特林癌症中心医学院,细胞治疗服务部; 2纽约纽约纪念斯隆·凯特林癌症中心医学系白血病服务; 3纽约州纽约的纪念斯隆·凯特林癌症中心纪念馆白血病服务部; 4纽约州纽约纪念斯隆·凯特林癌症中心骨髓移植服务部医学系; 5纽约州纽约的纪念斯隆·凯特林癌症中心护理部; 6纽约州纽约的纪念斯隆·凯特林癌症中心儿科,免疫发现和建模服务部; 7分子药理学计划,斯隆·凯特林研究所,纪念斯隆·凯特林癌症中心,纽约,纽约; 8威尔·康奈尔医学院,纽约,纽约; 9纽约纽约纪念斯隆·凯特林癌症中心; 10 Michael G. Harris Cell疗法和细胞工程设施,纽约纽约纪念Sloan Kettering癌症中心; 11 Takeda Development Center Americas,Inc。,马萨诸塞州列克星敦;纽约州纽约市纪念斯隆·凯特林癌症中心纪念儿科12; 13纽约州纽约市纪念斯隆·凯特林癌症中心医学系的细胞疗法服务和白血病服务; 14加利福尼亚州杜阿尔特市霍普国家医学中心的血液学和造血细胞移植系; 15纽约州布法罗市罗斯威尔公园综合癌症中心医学系
使用基础编辑扩展Intellia的工具箱
本演示文稿包含Intellia Therapeutics,Inc。(“ Intellia”,“我们”或“我们的”)的“前瞻性陈述”,这是1995年《私人证券诉讼改革法》的含义。这些前瞻性陈述包括但不限于有关Intellia关于我们的信念和期望的明示或暗示陈述:计划提交研究新药(“ IND”)申请(“ IND”)申请或类似的NTLA-5001申请申请,我们对我们的第一个T细胞受体(“ TCR”)指导的细胞治疗疗法开发在我们的急诊Myeloid Leukemia中(我们的第一个TCR)的候选人(“ TCR”)的培养基疗法(“ TCR”)(“ TCR”)(介绍)。评估NTLA-5001对以前接受过一线疗法的持续或经常性AML患者的预期;计划为我们的计划进行进步和完成临床前研究;开发专有的LNP/AAV混合输送系统,以及我们的模块化平台,以提高我们复杂的基因组编辑功能,例如基因插入;进一步开发我们的专有细胞工程过程,用于多个顺序或同时编辑;在即将举行的科学会议上介绍其他数据,以及2021年的其他临床前数据;我们的CRISPR/CAS9技术的进步和扩展以开发人类治疗产品,以及我们维护和扩展相关知识产权组合的能力;能够在临床前研究中证明我们平台的模块化并复制或应用结果,包括我们的attr,AML和HAE计划中的任何研究,包括人类临床试验,包括人类的临床试验;能够使用CRISPR/CAS9技术开发所有类型的其他类型的其他体内或Ex Vivo细胞疗法,尤其是针对AML中的WT1;以及我们产品候选人的潜在商业机会,包括价值和市场。
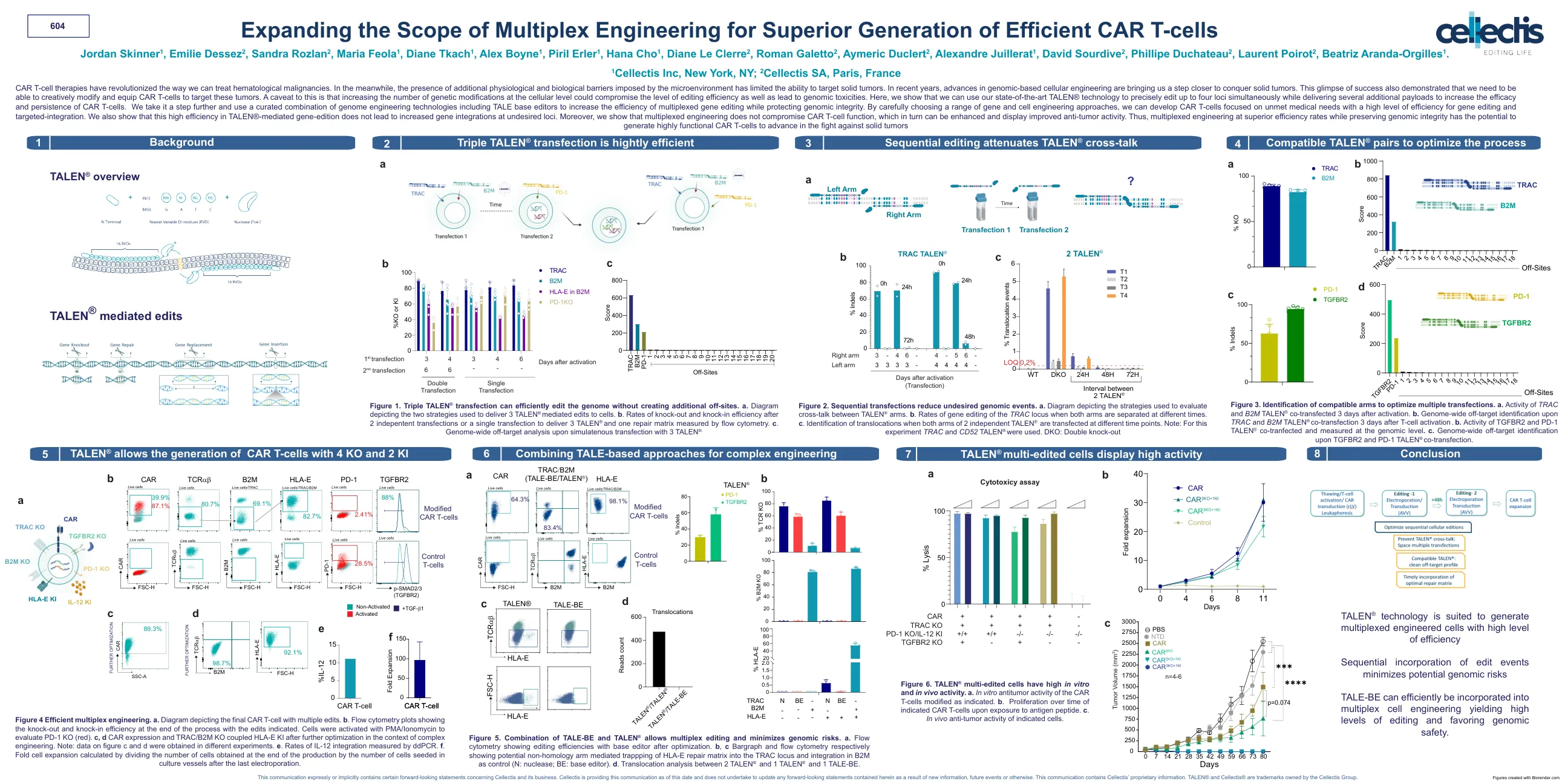
? TALEN 介导的编辑
CAR T 细胞疗法彻底改变了我们治疗血液系统恶性肿瘤的方式。与此同时,微环境造成的额外生理和生物障碍限制了针对实体瘤的能力。近年来,基于基因组的细胞工程的进步使我们距离攻克实体瘤又近了一步。这一成功的先例还表明,我们需要能够创造性地修改和装备 CAR T 细胞以针对这些肿瘤。需要注意的是,增加细胞水平的基因修饰数量可能会损害编辑效率水平并导致基因组毒性。在这里,我们展示了我们可以使用我们最先进的 TALEN® 技术同时精确编辑多达四个基因位点,同时提供多个额外的有效载荷以提高 CAR T 细胞的功效和持久性。我们更进一步,使用包括 TALE 碱基编辑器在内的基因组工程技术组合来提高多重基因编辑的效率,同时保护基因组完整性。通过精心选择一系列基因和细胞工程方法,我们可以开发专注于未满足医疗需求的 CAR T 细胞,并具有高水平的基因编辑和靶向整合效率。我们还表明,TALEN® 介导的基因编辑的这种高效率不会导致不需要的位点的基因整合增加。此外,我们表明多重工程不会损害 CAR T 细胞功能,而 CAR T 细胞功能反而可以得到增强并显示出更好的抗肿瘤活性。因此,在保持基因组完整性的同时以更高的效率进行多重工程有可能产生高功能性的 CAR T 细胞,以在对抗实体肿瘤方面取得进展
实体瘤的TCR工程T细胞疗法 Terahertz低损坏的介电特征...
T细胞工程改变了癌症免疫疗法的景观。嵌合抗原受体T细胞已表现出在血液学中B细胞恶性肿瘤治疗中具有显着的功效。然而,到目前为止,它们对实体瘤的临床影响已经适度。表达工程T细胞受体(TCR-T细胞)的 T细胞代表了有希望的治疗替代方案。 目标库不限于膜蛋白,并且TCR(例如高抗原敏感性和接近生理信号传导)的内在特征可以改善肿瘤细胞的检测和杀伤,同时改善T细胞持久性。 在这篇综述中,我们介绍了针对不同肿瘤抗原家族的TCR-T细胞获得的临床结果。 我们详细介绍了已经开发出来识别和优化TCR候选者的不同方法。 我们还讨论了TCR-T细胞疗法的挑战,包括毒性评估和抗性机制。 最后,我们分享了一些观点,并突出了该领域的未来方向。T细胞代表了有希望的治疗替代方案。目标库不限于膜蛋白,并且TCR(例如高抗原敏感性和接近生理信号传导)的内在特征可以改善肿瘤细胞的检测和杀伤,同时改善T细胞持久性。在这篇综述中,我们介绍了针对不同肿瘤抗原家族的TCR-T细胞获得的临床结果。我们详细介绍了已经开发出来识别和优化TCR候选者的不同方法。我们还讨论了TCR-T细胞疗法的挑战,包括毒性评估和抗性机制。最后,我们分享了一些观点,并突出了该领域的未来方向。