XiaoMi-AI文件搜索系统
World File Search System电动汽车的电池管理系统
如果SOC1大于SOC2,则将比较第一个Cell1和Cell2中的第一个SOC ,则开关(S1)将打开,并且能量将通过开关和电感器从Cell1转移到Cell1。 如果SOC2> SOC1,则开关(S2)将打开,并且能量将通过二极管1从Cell2转移到Cell1。 如果SOC3大于SOC4,则将比较Cell3和Cell4的SOC后,然后开关(S3)将打开,并且能量将通过开关和电感器从Cell3转移到Cell4。 如果SOC4> SOC3,则开关(S4)将打开,并且能量将通过二极管3转移到Cell4到Cell3。 如果SOC1大于SOC3,则将比较Cell1和Cell3的下一个SOC,然后开关(S1)&Switch(S2)将打开,能量将通过开关和电感器从Cell1转移到Cell1。 如果SOC3> SOC1,则开关(S3)将打开,并且能量将通过二极管2&Diode1从Cell3转移到Cell1。 如果SOC2大于SOC4,则将比较Cell2和Cell4的下一个SOC,然后开关(S2)&Switch(S3)将打开,能量将通过开关和电感器从Cell2转移到Cell2。 如果SOC4> SOC2,则开关(S4)将打开,并且能量将通过Diode3&Diode2从Cell4转到Cell2。 对于“ n”数量的细胞数将随后进行相同的过程。,则开关(S1)将打开,并且能量将通过开关和电感器从Cell1转移到Cell1。如果SOC2> SOC1,则开关(S2)将打开,并且能量将通过二极管1从Cell2转移到Cell1。如果SOC3大于SOC4,则将比较Cell3和Cell4的SOC后,然后开关(S3)将打开,并且能量将通过开关和电感器从Cell3转移到Cell4。如果SOC4> SOC3,则开关(S4)将打开,并且能量将通过二极管3转移到Cell4到Cell3。如果SOC1大于SOC3,则将比较Cell1和Cell3的下一个SOC,然后开关(S1)&Switch(S2)将打开,能量将通过开关和电感器从Cell1转移到Cell1。如果SOC3> SOC1,则开关(S3)将打开,并且能量将通过二极管2&Diode1从Cell3转移到Cell1。如果SOC2大于SOC4,则将比较Cell2和Cell4的下一个SOC,然后开关(S2)&Switch(S3)将打开,能量将通过开关和电感器从Cell2转移到Cell2。如果SOC4> SOC2,则开关(S4)将打开,并且能量将通过Diode3&Diode2从Cell4转到Cell2。对于“ n”数量的细胞数将随后进行相同的过程。
维生素D3抑制p38 MAPK和与衰老相关的炎症介质分泌,衰老成纤维细胞会影响衰老期间免疫反应的
fi g u r e 2 1,25(OH)2 D 3抑制成纤维细胞中衰老相关的介体和阻滞p38 MAPK。非元素和衰老成纤维细胞用10 nm 1,25(OH)2 d 3进行7天处理。(a)使用细胞仪珠阵列(n = 7)进行CCL2,IL-6和IL-8的定量。7天后计数非元素和衰老细胞的细胞数量,并根据其非年代对照组的细胞数成比例地调节衰老细胞上清液中的细胞数和浓度。(b)使用Western blot(c)(c)累积数据(n = 9)的Phosho-P38 MAPK(P-P38),总P38 MAPK和GAPDH的代表性印迹。数据表示为平均值±SEM,并使用单向方差分析和Dunn的多重比较测试进行比较。*p≤0.05; **p≤0.01; ***p≤0.001。
Mattila,Jaakko,Viitanen,Arto,Fabris,Gaia,Strutynska,Tetiana,Tetiana,Korzelius,Jerome和Hietakangas,Ville(2024)干细胞MTOR MTOR信号指导R
成年肠是一个区域化器官,其大小和细胞组成是根据营养状态调整的。这涉及肠道干细胞(ISC)增殖和分化的动态调节。Nu-Trient信号如何控制细胞命运决策以驱动细胞类型组成的区域变化尚不清楚。在这里,我们表明肠道营养适应涉及细胞大小,细胞数和分化的区域特异性控制。我们发现MTOR复合物1(MTORC1)的激活以特定于区域的方式增加了ISC的大小。mTORC1活性促进了三角洲表达,将细胞命运引导到吸收性肠细胞谱系,同时抑制分泌的肠肠分离细胞分化。在老化的苍蝇中,ISC MTORC1信号被解剖,组成型高且对饮食无反应,可以通过终身间歇性禁食来缓解这种饮食。总而言之,MTORC1信号传导有助于ISC命运决策,从而使肠道细胞分化的区域控制对营养。
一种优化的定量蛋白质组学方法建立了细胞类型的小鼠脑分泌
要了解细胞如何在神经系统中进行通信,必须定义其分泌组,这对于原代细胞的挑战很大,因为需要大细胞数。在这里,我们通过开发“用点击糖的高性能分泌蛋白富集”(HISPECS)方法来小型分泌组分析。为了证明其广泛的效用,HISPEC用于确定脑切片对LPS诱导的神经炎症的分泌反应,并使用原代星形胶质细胞,微神经胶质,神经元和寡聚细胞来建立细胞类型分辨的小鼠脑秘密资源。该资源允许映射CSF蛋白的细胞起源,并揭示出意外的体外和体内分泌的蛋白质出乎意料的是蛋白水解裂解的膜蛋白extodomain。两个例子是神经分泌的Adam 22和CD 200,我们将其确定为阿尔茨海默氏症连接蛋白酶贝丝的底物1。hispecs和脑部分泌资源可以被广泛利用,以系统地研究蛋白质分泌和脑功能,并鉴定CNS疾病的细胞类型特异性生物标志物。
DNA复制叉速度在皮质神经发生中充当发动机
a,示意图,显示了MCMBP介导的组装,并将MCM3-7导出到核中,该核能形成新生的MCM,用MCM2作为恢复前复合物,并调节DNA复制叉速度。nls表示核定位信号。b,从顶端到基础位置的MCMBP的时空表达,从E12.5到E15.5。c,蛋白质印迹分析显示了皮质发育产前和产后阶段的MCMCBP表达模式。d,在P3处的CKO小鼠和同窝对照的代表性图像。红色星星指示CKO鼠标。e,(左图)MCMBP +/ +的背视图; EMX1-CRE和MCMBP FL/FL; EMX1-CRE(CKO)P4大脑。(右图)与同窝对照(CTRL)相比,CKO中的皮质区域显着降低。(平均,两尾未配对的t检验,ctrl:n = 7,cko:n = 5)。f,(左图)MCMBP +/ +和CKO P4脑的DAPI染色冠状切片。与同窝对照(CTRL)相比,CKO的皮质板厚度显着降低了皮质板厚度。(平均,两尾未配对的t检验,ctrl:n = 7,cko:n = 5)。g,MCMBP +/ +的P4脑中的层标记物BRN2,TBR1,LHX2和TLE4的免疫染色; EMX1-CRE和CKO。h,与同窝对照组(CTRL)相比,CKO的上层神经元显着降低。(均值,两尾未配对的t检验,BRN2,TBR1,CTRL:n = 8,cko:n = 5,lhx2,tle4,ctrl:n = 4,cko:cko:n = 4)。i,蛋白质印迹分析显示了E15.5,E16.5和P4 Cortex中MCMCBP表达的下调。(平均,两尾未配对的t检验,ctrl:n = 3,cko:n = 3)。J,MCMBP +/ +中的顶祖细胞标记物SOX2和中间祖细胞标记的免疫染色; EMX1-CRE和CKO从E12.5到E16.5。K,SOX2+细胞数分析表明,在E12.5处CTRL和CKO之间没有差异。但是,由于E13.5,Sox2+细胞显着降低并持续到E16.5。(mean, two-tailed unpaired t-test, E12.5, ctrl: n=5, cKO: n=4, E13.5, ctrl: n=4, cKO: n=3, E14.5, ctrl: n=5, cKO: n=5, E15.5, ctrl: n=6, cKO: n=4, E16.5, ctrl: n=6, CKO:n = 4)。l,EOMES+细胞数分析表明,在E12.5和E13.5处CTRL和CKO之间没有差异。但是,Eomes+细胞从E14.5显着降低到E16.5。(mean, two-tailed unpaired t-test, E12.5, ctrl: n=3, cKO: n=3, E13.5, ctrl: n=4, cKO: n=4, E14.5, ctrl: n=4, cKO: n=4, E15.5, ctrl: n=4, cKO: n=3, E16.5, ctrl: n=4, CKO:n = 3)。
大脑周细胞的发展需要在中间前体中表达转录因子NKX3.1
脑周细胞是调节内皮屏障功能和活性的关键细胞类型之一,从而确保足够的血液流向大脑。尚不清楚将未分化的细胞引导到成熟的周细胞中的遗传途径。我们在这里表明,斑马鱼的神经rest和中胚层的周细胞前体种群表示转录因子NKX3.1发展成脑周细胞。我们确定了这些前体的基因特征,并表明NKX3.1,FOXF2A和CXCL12B表达周围的周围前体群体存在于动脉形成和周细胞募集之前的基底动脉周围。前体随后散布在整个大脑中,并分化以表达规范的周细胞标记。cxcl12b- cxcr4信号传导是细节附着和分化所必需的。此外,随着损失的损失和增益增加,NKX3.1和CXCL12 B在调节周细胞数方面都是必需的,并且足够。通过遗传实验,我们为脑周细胞定义了前体群体,并确定了对其分化至关重要的基因。
平面人通过使用干细胞系统在体型变化期间保持不同细胞类型的恒定比率
平面人会根据喂食还是饥饿的条件来改变体型。为了调查平面主义者如何调节这种柔性系统,计算了总细胞和特定细胞类型的数量,并比较了2 mm至9毫米的蠕虫。总细胞数随体长的增加线性增加,但是头部和躯干部分之间的细胞数量是恒定的(1:3)。有趣的是,使用细胞类型特异性抗体进行免疫染色后,计算眼睛和大脑中特定的神经元的数量表明,无论大脑和身体大小如何,不同神经元类型之间的比率是恒定的。这些结果表明,平面主义者可以通过保持不同细胞类型的恒定比例来维持比例,同时改变身体大小。了解该系统并揭示pla-narians如何在眼睛和脑再生过程中恢复原始比率,在再生过程中研究了专门细胞的数量。结果进一步证实了某种形式的“计数机制”的存在,这些机制具有调节复杂器官(例如细胞更新,饥饿和再生)等复杂器官(例如大脑)中不同细胞类型的绝对数量和相对数字。
微流体器官培养物源自胰腺癌活检,用于化学疗法和免疫疗法的个性化测试
患者衍生的癌症类器官(PDOS)具有个性化治疗选择和改善患者预后的巨大希望。但是,在标准文化平台中生成足够数字的PDO来测试疗法是一项挑战。这一挑战对于胰腺导管腺癌(PDAC)特别急切,在该胰腺导管腺癌(PDAC)中,大多数患者在晚期患有不可切除的肿瘤的晚期诊断,并且患者组织的形式是针头活检。描述了使用有限量的PDAC活检可用的组织或PDO进行测试疗法的微流体设备的开发和表征。证明微流体PDO在表型和基因型上与金色标准的Matrigel类器官相似,其优点为1)球体均匀性,2)最小的细胞数需求,3)不依靠Matrigel。通过测试对几种化学疗法的PDO响应,包括糖原合酶激酶(GSKI)的抑制剂,可以证明微流体PDOS的效用。此外,微氟机培养物用于测试由NK细胞组成的免疫疗法的有效性与新型生物学结合。总而言之,我们的微流体装置对基于癌症活检的个性化肿瘤学有很大的好处,并且将来可能会发展成为化学疗法或免疫疗法治疗的伴侣诊断。
簇细胞在人1肠2
在小鼠中,肠道簇细胞被描述为一种长期寿命的有丝分裂后细胞类型,其中30个已经鉴定出了两个不同的子集,称为Tuft-1和Tuft-2 1。通过结合对31次人类肠道切除材料和肠道器官的分析,我们确定了四个不同的32个人簇细胞状态,其中两个与它们的鼠重叠。我们表明,簇簇33细胞的发育取决于Wnt配体的存在,簇状细胞数在白介素(IL)-4和IL-13暴露后迅速增加34,如小鼠2-4中报道。这35个是通过预先存在的簇细胞的扩散而来发生的,而不是通过从干细胞中增加的36产生来发生。的确,在胎儿和成人37人类肠道中,增殖性簇细胞在体内都存在。单个成熟的增殖簇细胞可以形成含有所有38种肠上皮细胞类型的器官。与干细胞和祖细胞不同,人簇细胞生存39辐射损伤,并保留产生所有其他上皮细胞类型的能力。因此,缺乏簇簇细胞的40种手机无法从辐射诱导的损伤中恢复。因此,41个簇细胞代表了人类损伤诱导的储备肠干细胞库。42
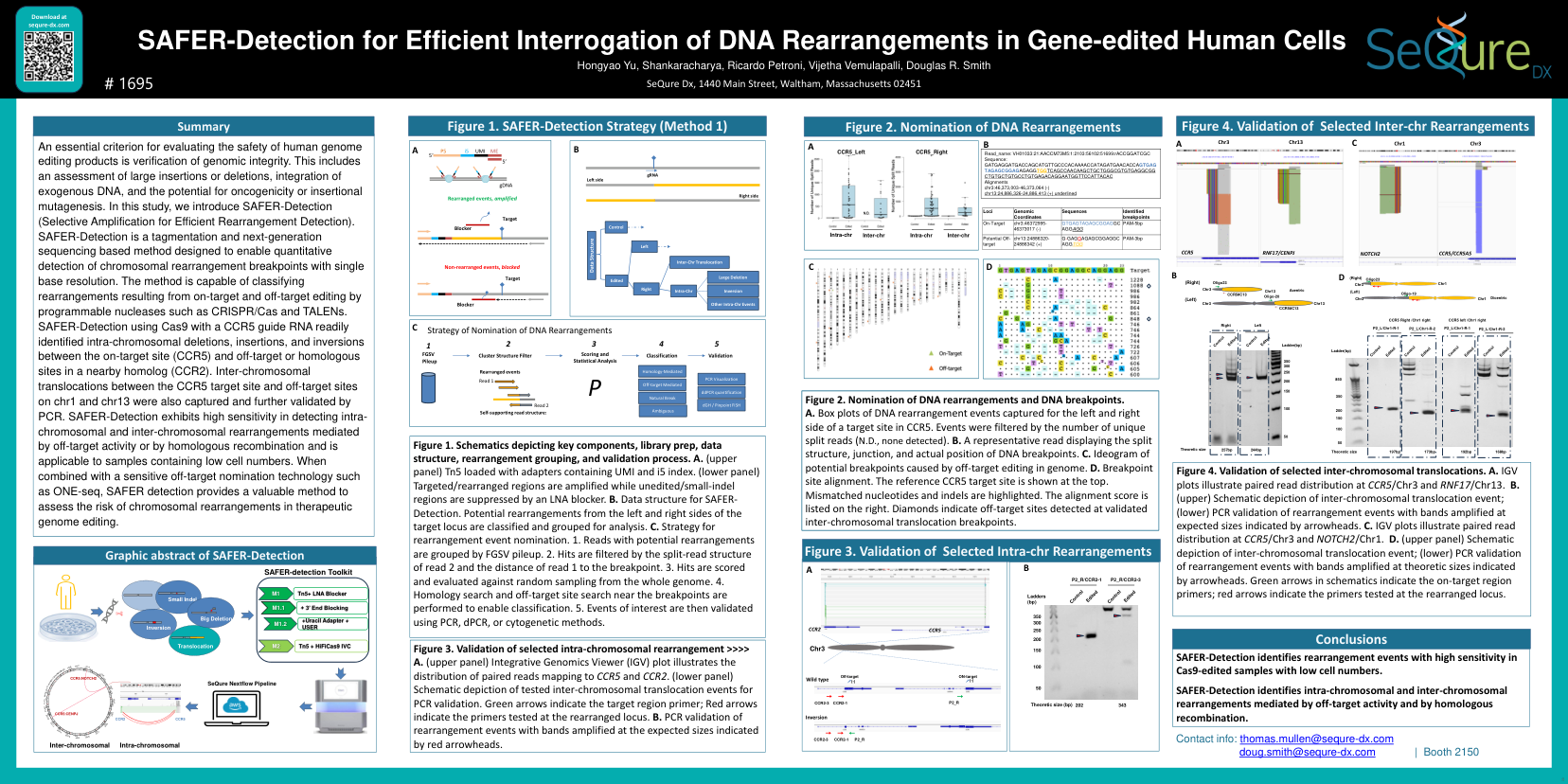
SAFER-Detection 用于有效检测基因编辑人类细胞中的 DNA 重排
评估人类基因组编辑产品安全性的一个重要标准是验证基因组完整性。这包括对大量插入或缺失、外源 DNA 整合以及致癌性或插入诱变可能性的评估。在本研究中,我们介绍了 SAFER-Detection(高效重排检测的选择性扩增)。SAFER-Detection 是一种基于标记和下一代测序的方法,旨在以单碱基分辨率定量检测染色体重排断点。该方法能够对由可编程核酸酶(如 CRISPR/Cas 和 TALEN)进行的靶向和脱靶编辑导致的重排进行分类。SAFER-Detection 使用 Cas9 和 CCR5 向导 RNA,可轻松识别靶位点 (CCR5) 与附近同源物 (CCR2) 中的脱靶或同源位点之间的染色体内缺失、插入和倒位。CCR5 靶位点与 chr1 和 chr13 上的脱靶位点之间的染色体间易位也被捕获并通过 PCR 进一步验证。SAFER-Detection 在检测由脱靶活动或同源重组介导的染色体内和染色体间重排方面表现出高灵敏度,适用于含有低细胞数的样本。当与灵敏的脱靶提名技术(如 ONE-seq)结合使用时,SAFER 检测提供了一种评估治疗性基因组编辑中染色体重排风险的宝贵方法。