XiaoMi-AI文件搜索系统
World File Search SystemSema4:以患者为中心的
Natalis:• 补充新生儿筛查诊断面板:• 听力和视力丧失 • 心脏缺陷 • 原发性免疫缺陷/IBD • 神经发育面板,包括 Noonan 综合征和 ASD • 骨骼发育不良/肢体缺陷 • 小头畸形 • 诊断外显子组
2024 年秋季 – 9 月、10 月和 11 月
秋季学期:2024 年 9 月 16 日 – 11 月 23 日(9 周学期)会员 122 美元,非会员 141 美元星期一下午 5 – 5:30 白鲸(3-5 岁);温水池下午 5:35 – 6:20 座头鲸(6-10 岁);游泳池下午 6:30 – 7 点小头鲸(6 个月-3 岁);温水池晚上 7 – 7:45 成年鲸;温水池星期三晚上 6:30 – 7:15 鲸鲨(11-14 岁)晚上 7:15 – 8 点成人星期六上午 9 – 9:30 小头鲸(6 个月-3 岁);温水池 9:35 – 10:05 am 鲸鲨 (11-14 岁) 温水池 10:15 — 10:45 am 白鲸 (3-5 岁); 温水池 11 – 11:45 am 座头鲸 (6-10 岁); 温水池
ana raquel gouveia freitas da Silva
简介:DYRK1A杂合致病变异已被证明会导致智力障碍(ID)的综合征形式,其言语发育受损,自闭症谱系障碍(ASD)的特征,小头畸形和可识别的面部面部因素随着年龄的增长而发育。患者还可以出现步态障碍或高血压,癫痫,大脑成像,眼和脚异常。方法:这是一项横断面研究。使用详细的临床问卷从医疗记录中回顾性地收集了从医疗记录收集的,在里斯本的临床遗传学系鉴定出DYRK1A致病变异患者的临床数据。结果:我们描述了八名无关患者,六名女性和2名男性,年龄4至24岁。胎儿生长限制(FGR)在5/8中存在,而小头畸形为7/8。ID在所有患者中都记录在轻度到重度和语言障碍或缺乏语言的情况下。ASD和/或刻板印象行为在6/8中报道。 五名患者出现了视觉异常,最常见的是光盘盘pallor(4)。 始终报道了三个主要的面部特征:深度凝视的眼睛,薄唇和微/疗法。 脚和手动异常经常发生。 讨论/结论:我们的队列说明了ID的综合症形式的严重程度可变程度,其中包括轻度病例。 小头畸形和典型的神经行为表型符合文献以及一些常见的畸形。 有趣的是,视盘苍白似乎是一个频繁的发现,强调了对眼科监视的需求。ASD和/或刻板印象行为在6/8中报道。五名患者出现了视觉异常,最常见的是光盘盘pallor(4)。始终报道了三个主要的面部特征:深度凝视的眼睛,薄唇和微/疗法。脚和手动异常经常发生。讨论/结论:我们的队列说明了ID的综合症形式的严重程度可变程度,其中包括轻度病例。小头畸形和典型的神经行为表型符合文献以及一些常见的畸形。有趣的是,视盘苍白似乎是一个频繁的发现,强调了对眼科监视的需求。我们的研究为与DYRK1A相关ID的一致临床表型的存在增加了证据,希望有助于提高认识并提高对该实体的认识。
巴西累西腓寨卡病毒相关小头畸形儿童的早期癫痫:特征、脑电图发现和治疗
摘要 目的:估计出生后 24 个月内寨卡病毒相关小头畸形儿童癫痫的发病率;描述相关临床和电图表现;并总结治疗反应。方法:我们对一批在 2015-2016 年巴西寨卡病毒 (ZIKV) 流行期间出生的儿童进行了随访,这些儿童患有先天性小头畸形,并且神经影像学和/或实验室检查有先天性寨卡病毒感染的证据。在出生后 3、6、12、15、18、21 和 24 个月进行神经系统评估。在出生后 24 个月内进行了连续脑电图检查。结果:我们评估了 91 名儿童,其中 48 名为女孩。在本研究样本中,出生后 24 个月内癫痫的累积发病率为 71.4%,主要癫痫类型是婴儿痉挛 (83.1%)。癫痫发作的最高发病率发生在3至9个月龄之间,直到15个月龄之前,这种风险仍然很高。婴儿痉挛的发病率在4至7个月龄之间达到峰值,随后在12个月龄后,局灶性癫痫的发病率增加。所有儿童都有神经影像学结果,100%为异常。在接受计算机断层扫描评估的74名儿童中,78.4%的儿童被诊断出皮质异常,在接受磁共振成像评估的53名儿童中,100%的儿童被诊断出皮质异常。总体而言,65名患有癫痫的儿童中只有46.1%对治疗有反应。
Amish致命的微头畸形
参考文献•凯利·RI,罗宾逊D,普芬伯格,例如施特劳斯·卡,莫顿DH。Amish致死性畸形:一种新的代谢疾病,具有严重的先天性小头畸形和2-酮戊二酸尿。Am J Med Genet。2002年11月1日; 112(4):318-26。 doi:10。 1002/ajmg.10529。 引用于PubMed(https://pubmed.ncbi.nlm.nih.gov/12376931)•korf br。 神经遗传学的新内容? Amish小头畸形。 Eur J Paediatrneurol。 2003; 7(6):393-4。 doi:10.1016/j.ejpn.2003.09.005。 没有抽象可用。 引用PubMed(https://pubmed.ncbi.nlm.nih.gov/14623217)•Lindhurst MJ,Fiermonte G,Song S S,Struys E,De Leonardis E,De Leonardis F,Schwartzberg pl,Schwartzberg pl,Chen a,Chen a,Chen a,Castegna a,castegna a,castegna a,verhebies n,bies bies bies bies bies beck b,Mathere ckk,Mathere ck,Mathereck,Mathereck。 敲除SLC25A19导致线粒体硫胺素吡啶磷酸盐耗竭,胚胎杀伤性,CNS畸形和贫血。 Proc Natl Acad Sci U S A. 2006 Oct24; 103(43):15927-32。 doi:10.1073/pnas.0607661103。 Epub 2006年10月11日。 引用PubMed(https://pubmed.ncbi.nlm.nih.gov/17035501)或PubMed Central上的免费文章(https://www.ncbi.ncbi.nlm.nlm.nih.gov/pmc/articles/pmc/articles/pmc1595310/) Fiermonte G,Hilliard MS,Kocht,Kalikin LM,Makalowska I,Morton DH,Petty EM,Weber JL,Palmieri F,Kelleyri,Kelleyri,Schaffer AA,Biesecker LG。 突变的脱氧核苷酸载体与象征小头畸形有关。 nat Genet。 2002年9月; 32(1):175-9。 doi:10.1038/ng948。 Epub 2002 8月19日。 引用于PubMed(https://pubmed.ncbi.nlm.nih.gov/12185364)2002年11月1日; 112(4):318-26。 doi:10。1002/ajmg.10529。引用于PubMed(https://pubmed.ncbi.nlm.nih.gov/12376931)•korf br。神经遗传学的新内容?Amish小头畸形。Eur J Paediatrneurol。2003; 7(6):393-4。 doi:10.1016/j.ejpn.2003.09.005。没有抽象可用。引用PubMed(https://pubmed.ncbi.nlm.nih.gov/14623217)•Lindhurst MJ,Fiermonte G,Song S S,Struys E,De Leonardis E,De Leonardis F,Schwartzberg pl,Schwartzberg pl,Chen a,Chen a,Chen a,Castegna a,castegna a,castegna a,verhebies n,bies bies bies bies bies beck b,Mathere ckk,Mathere ck,Mathereck,Mathereck。敲除SLC25A19导致线粒体硫胺素吡啶磷酸盐耗竭,胚胎杀伤性,CNS畸形和贫血。Proc Natl Acad Sci U S A.2006 Oct24; 103(43):15927-32。 doi:10.1073/pnas.0607661103。 Epub 2006年10月11日。 引用PubMed(https://pubmed.ncbi.nlm.nih.gov/17035501)或PubMed Central上的免费文章(https://www.ncbi.ncbi.nlm.nlm.nih.gov/pmc/articles/pmc/articles/pmc1595310/) Fiermonte G,Hilliard MS,Kocht,Kalikin LM,Makalowska I,Morton DH,Petty EM,Weber JL,Palmieri F,Kelleyri,Kelleyri,Schaffer AA,Biesecker LG。 突变的脱氧核苷酸载体与象征小头畸形有关。 nat Genet。 2002年9月; 32(1):175-9。 doi:10.1038/ng948。 Epub 2002 8月19日。 引用于PubMed(https://pubmed.ncbi.nlm.nih.gov/12185364)2006 Oct24; 103(43):15927-32。 doi:10.1073/pnas.0607661103。Epub 2006年10月11日。引用PubMed(https://pubmed.ncbi.nlm.nih.gov/17035501)或PubMed Central上的免费文章(https://www.ncbi.ncbi.nlm.nlm.nih.gov/pmc/articles/pmc/articles/pmc1595310/) Fiermonte G,Hilliard MS,Kocht,Kalikin LM,Makalowska I,Morton DH,Petty EM,Weber JL,Palmieri F,Kelleyri,Kelleyri,Schaffer AA,Biesecker LG。突变的脱氧核苷酸载体与象征小头畸形有关。nat Genet。2002年9月; 32(1):175-9。 doi:10.1038/ng948。Epub 2002 8月19日。引用于PubMed(https://pubmed.ncbi.nlm.nih.gov/12185364)
一种新型的METTL5变体破坏供体剪接站点导致伊朗家庭中与小头畸形相关的主要智障:临床特征和文献评论
摘要。智力残疾(ID)是一种高度异质性疾病,影响了世界人口的1-3%,这与认知发展,适应性功能和人类生活中的行为问题的重要障碍有关。在这项研究中,由于该疾病的遗传异质性,全外象征测序(WES)是对一个患有微观脑的13岁男孩进行的。此外,进行了Sanger测序,Cosegregation分析和结构建模,以识别和验证家族中概率和强制性载体中的因果变体。wes在Mettl5基因的第二个外显子的供体剪接位点中揭示了一种新颖的,纯合的10 bp缺失(NM_014168:c.223_224?8del),发现与谱系中的表型隔离。根据美国医学遗传学学院(ACMG)变体解释指南,该变体符合致病性的标准。到目前为止,已经报道了Mettl5基因的四个致病性纯合变量与ID相关。比较我们患者的临床特征与先前报道的病例的临床特征显示疾病严重程度和某些临床表现的变化,包括整体生长,畸形面部特征和行为精神病表现。本研究报告的病例的临床发现扩展了与ID相关的遗传变异和表型的频谱,并可以更好地了解疾病发病机理。
原创文章 SOX11 的缺失和新生突变与具有 Cof-Siris 综合征特征的神经发育障碍有关
摘要 背景 SOX11 是一种转录因子,被认为在大脑发育中发挥作用。最近有报道称两例 Cofín - Siris 综合征患者出现 SOX11 突变,这表明 SOX11 与人类发育障碍有关。在这里,我们进一步研究 SOX11 变异在神经发育障碍中的作用。方法 我们使用基于阵列的比较基因组杂交和三外显子组测序来识别患有智力障碍的儿童,这些儿童的 SOX11 基因缺失或从头点突变会破坏 SOX11。使用体外基因表达报告系统评估 SOX11 突变的致病性。通过敲低 Sox11 表达在非洲爪蟾中进行了功能丧失实验。结果 我们确定了七个个体的 2p25 染色体缺失涉及 SOX11。三外显子组测序鉴定出三种新生 SOX11 变异体,两种错义(p.K50N;p.P120H)和一种无义(p.C29*)。利用体外基因表达系统评估错义突变的生物学后果。这些个体患有小头畸形、发育迟缓和与轻度 Cof - Siris 综合征相符的共同畸形特征。为了进一步研究 SOX11 的功能,我们敲除了非洲爪蟾中的直系同源基因。与对照组相比,变异体的头部尺寸显著减小。这表明 SOX11 功能丧失可能与小头畸形有关。结论因此,我们提出 SOX11 缺失或突变可能表现出 Cof - Siris 表型。
NPC 和斑马鱼中方法和工具的开发...
识别导致神经遗传疾病的 DNA 变异的主要瓶颈是 VUS 的功能分析。本研究的目的是通过在 NPC 和斑马鱼中使用 CRISPR/Cas9 基因组编辑来开发一种方法,以对在巨脑回患者中观察到的候选致病变异进行建模。通过 aCGH 和 WES 分析了 20 名巨脑回/无脑回患者的 DNA,并确定了变异的优先级。通过使用 CRISPR/Cas9 基因组编辑在 NPC 和斑马鱼中生成突变系,并与已知在巨脑回/无脑回中发挥作用的三个关键基因(TUBG1、LIS1、DAB1)之一的模型进行了比较。使用 3D 基质胶腔系统 (ICChip) 对 NPC 进行表征,并在 3 dpf 和 5 dpf 时观察到发育中的斑马鱼的表型变化。使用 qPCR 对目标突变系和选定的变体系进行了比较。与对照组相比,在 3 个选定基因的突变 NPC 系中观察到迁移延迟。WES 确定了两个候选变体,CGREF1 和 NOL9。观察到 CGREF1KO 斑马鱼和 CGREF1KONPC 中无脑畸形和小头畸形相关基因和神经元分化基因的表达变化。在 Tubg1 突变斑马鱼中观察到严重的表型,包括小头和小眼,以及肝脏/肠道发育异常。我们的研究结果证明,使用 NPC 和斑马鱼模型可以以省时省钱的方式测试导致与 NPC 迁移相关的缺陷的变异。多组学分析可以进一步将这种方法的使用范围扩展到其他神经遗传缺陷组。该项目由 TUBITAKCOST Action 资助,代码号为 217S944。
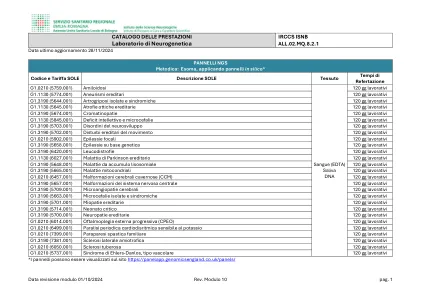
神经遗传学实验室
120 个工作日 G1.1130 (5774.001) 遗传性动脉瘤 120 个工作日 G1.3190 (5644.001) 孤立性和综合征性关节挛缩 120 个工作日 G1.1130 (5645.001) 遗传性视神经萎缩 120 个工作日 G1.3190 (5674.001) 色素病变 120 个工作日 G1.1130 (5845.001) 智力残疾和小头畸形 120 个工作日 G1.3190 (5703.001) 神经发育障碍 120 个工作日 G1.3190 (5702.001) 遗传性运动障碍 120 个工作日 G1.0210 (5902.001) 局灶性癫痫 120 个工作日 G1.3190 (5658.001) 遗传性癫痫 120 个工作日 G1.3190 (6420.001) 脑白质营养不良 120 个工作日 G1.1130 (6027.001) 遗传性帕金森病 120 个工作日 G1.3190 (5648.001) 溶酶体贮积症 120 个工作日 G1.3190 (5665.001) 线粒体疾病 120 个工作日 G1.0210 (6457.001) 脑海绵状畸形 (CCM) 120 个工作日 G1.3190 (5657.001) 中枢神经系统畸形 120 个工作日工作日 G1.3190 (5709.001) 脑微血管病 120 个工作日 G1.3190 (5663.001) 孤立性和综合征性小头畸形 120 个工作日 G1.3190 (5701.001) 遗传性肌病 120 个工作日 G1.3190 (5714.001) 危重新生儿 120 个工作日 G1.3190 (5700.001) 遗传性神经病 120 个工作日 G1.0210 (6014.001) 进行性外眼肌麻痹 (CPEO) 120 个工作日 G1.0210 (6499.001) 对钾敏感的心律失常性周期性麻痹 120 个工作日 G1.0210 (7399.001) 家族性痉挛性截瘫120 个工作日 G1.3190 (7381.001) 肌萎缩侧索硬化症 120 个工作日 G1.0210 (6050.001) 结节性硬化症 120 个工作日 G1.0210 (5737.001) 血管型 Ehlers-Danlos 综合征 120 个工作日 *面板可在 https://panelapp.genomicsengland.co.uk/panels/ 查看
Ankara中0-2岁儿童的生长曲线和百分位数的头圆周:与Gamlss和分位数回归方法进行比较
测量HC是一种快速,无创的方法,用于确定婴儿的头部太大(兆脑)还是太小(小头畸形)。6与标准生长曲线相比,常规的HC测量对于跟踪婴儿的健康至关重要。该程序被认为是“最简单,最便宜,最快的[工具],用于评估中央系统的发展和确定有神经发育障碍风险的新生儿。” 7头圆周也经常在处于危险的婴儿(例如早产或低胎胎婴儿或患有已知遗传疾病的患者)中测量;大多数临床医生在常规良好的访问中包括串行HC测量,或者是由于生长关节以外的原因(即机会性增长测量值)以外的其他婴儿和儿童的定期护理。8