XiaoMi-AI文件搜索系统
World File Search System靶向组蛋白去乙酰化酶增强Erastin诱导的铁死亡对EGFR激活突变肺腺癌的治疗效果
肺癌是死亡率最高的恶性肿瘤,而肺腺癌(LUAD)占所有肺癌的40%(1)。在亚洲,表皮生长因子受体(EGFR)是LUAD最常见的驱动突变,发生率为55%(2-4),其中EGFR激活突变在全球占17.4%,在中国占37.3%(5)。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)目前是EGFR突变LUAD患者的标准一线治疗方案(6)。尽管使用EGFR-TKI已为晚期EGFR突变型NSCLC患者带来显著的临床获益和前所未有的生存率提高(7-10),但不可避免地会产生获得性耐药。继发性EGFR突变,包括EGFR-T790M突变和EGFR结构域内的其他突变、MAPK、PI3K和细胞周期基因的突变以及EGFR或其他致癌基因如MET的扩增,导致LUAD细胞获得性EGFR-TKI耐药(11-13)。但有些患者在缺乏已知耐药机制的情况下获得了EGFR-TKI耐药。因此,内在性EGFR-TKI耐药是临床上的一个挑战。据报道,大约20%-30%的EGFR突变型LUAD对EGFR-TKI具有内在性耐药(14)。因此,如何克服这些获得性和内在性的EGFR-TKI耐药一直是临床关注的焦点。
DNA损伤修复改变对前列腺癌进展和转移的影响
前列腺癌是全球最常见的疾病之一。尽管最近在治疗方面取得了进展,但晚期前列腺癌的患者的预后较差,并且该人群的需求很高。了解前列腺癌的分子决定因素和疾病的侵袭性表型可以帮助设计更好的临床试验并改善这些患者的治疗方法。晚期前列腺癌经常改变的途径之一是DNA损伤反应(DDR),包括BRCA1/2的改变和其他同源重组修复(HRR)基因。DDR途径的改变在转移性前列腺癌中尤为普遍。在这篇综述中,我们总结了原发性和晚期前列腺癌中DDR改变的普遍性,并讨论了DDR途径中的变化对DDR基因的侵袭性疾病表型,预后和种系致病性的关联的影响,而DDR基因与患有前列腺癌风险的DDR基因改变了。
基于CAR的乳腺癌免疫疗法
手术、化疗及内分泌治疗提高了Luminal A、Luminal B及HER-2阳性乳腺癌的总生存率和术后复发率,但对于预后不良的三阴性乳腺癌(TNBC)的治疗方式仍然有限。迅速发展的嵌合抗原受体(CAR)-T细胞疗法在血液系统肿瘤中的有效应用为乳腺癌的治疗提供了新的思路。选择合适、针对性的靶点是CAR-T疗法应用于乳腺癌治疗的关键。本文在现有的研究进展基础上,总结了CAR-T疗法在不同亚型中的有效靶点和潜在靶点,尤其是针对TNBC。以CAR为基础的免疫疗法使得乳腺癌的治疗取得了进展,CAR-巨噬细胞、CAR-NK细胞和CAR-间充质干细胞(MSCs)可能对治疗乳腺癌等实体肿瘤更有效、更安全。然而乳腺肿瘤的肿瘤微环境(TME)和CAR-T疗法的副作用对CAR免疫治疗提出了挑战。CAR-T细胞和CAR-NK细胞衍生的外泌体在肿瘤治疗中具有优势。携带CAR的外泌体用于乳腺癌免疫治疗具有巨大的研究价值,可能提供一种治疗效果良好的治疗方式。在本综述中,我们概述了CAR免疫治疗在治疗不同亚型乳腺癌中的发展和挑战,并讨论了表达CAR的外泌体用于乳腺癌治疗的进展。我们详细阐述了CAR-T细胞在TNBC治疗中的发展以及使用CAR-巨噬细胞,CAR-NK细胞和CAR-MSCs治疗乳腺癌的前景。
大麻素和三阴性乳腺癌治疗
三阴性乳腺癌 (TNBC) 约占所有乳腺癌病例的 10-20%,预后不良。直到最近,TNBC 的治疗选择仅限于化疗。一种新的成功全身治疗方法是使用免疫检查点抑制剂的免疫疗法,但需要新的肿瘤特异性生物标志物来改善患者的预后。大麻素在大多数 TNBC 模型的临床前研究中表现出抗肿瘤活性,并且似乎对化疗没有不良影响。需要临床数据来评估对人类的疗效和安全性。重要的是,内源性大麻素系统与免疫系统和免疫抑制有关。因此,大麻素受体可能是免疫检查点抑制剂疗法的潜在生物标志物或逆转免疫疗法耐药性的新机制。在本文中,我们概述了目前可用的有关大麻素如何影响 TNBC 标准疗法的信息。
RET 抑制可克服 ER+ 乳腺癌对 CDK4/6 抑制剂和内分泌疗法的耐药性
方法:为了确定与联合内分泌治疗和 CDK4/6i 耐药相关的基因表达改变,我们对两种对该联合治疗有耐药性的 ER+ 乳腺癌细胞模型进行了 RNA 测序。通过 siRNA 介导的 RET 沉默和 FDA/EMA 批准的 RET 选择性抑制剂 selpercatinib 在耐药乳腺癌细胞和患者来源的类器官 (PDO) 中的靶向抑制来评估 RET 的功能作用。使用全局基因表达和通路分析从机制上评估 RET 沉默。通过对接受内分泌治疗的原发性肿瘤进行基因阵列分析,以及对接受联合 CDK4/6i 和内分泌治疗的患者的转移性病变进行免疫组织化学评分,研究了 ER+ 乳腺癌中 RET 表达的临床相关性。
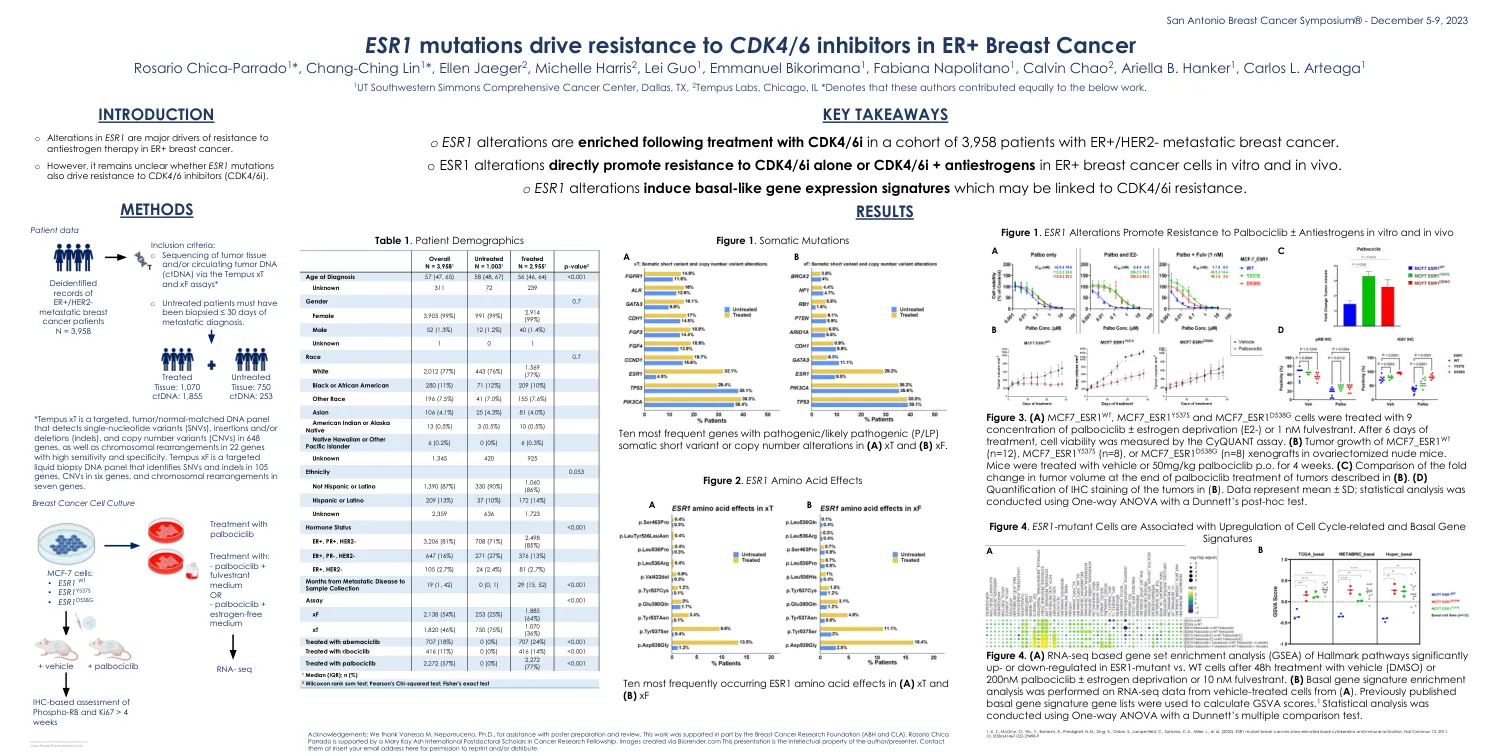
ESR1突变驱动对ER+乳腺癌中CDK4/6抑制剂的抗性
图3。(a)MCF7_ESR1 WT,MCF7_ESR1 Y537S和MCF7_ESR1 D538G细胞用9浓度的palbociclib±雌激素剥夺(E2-)或1 nm fulvesterant处理。治疗6天后,通过曲面测定法测量细胞活力。(b)MCF7_ESR1 WT的肿瘤生长(n = 12),MCF7_ESR1 Y537S(n = 8)或MCF7_ESR1 D538G(N = 8)异种移植物在卵巢肌切除术中。小鼠用车辆或50mg/kg Palbociclib P.O.持续4周。(c)在(b)中描述的肿瘤处理结束时肿瘤体积的折叠变化的比较。(d)(b)中肿瘤的IHC染色定量。数据代表平均值±SD;使用Dunnett的事后测试使用单向方差分析进行统计分析。
AI在乳腺癌诊断中将假阳性降低37.3%
多项研究表明,AI正在显着提高诊断准确性。在自然传播中发表的一项研究表明,放射科医生级的AI系统可帮助放射科医生在乳房超声诊断中降低其假阳性率37.3%。同样,由NHS测试的AI工具分析了10,000多种乳房X线照片,识别了所有乳腺癌病例,包括人类医生错过的11例。
黑白患者胰腺癌的分子差异
在《 AACR期刊》中出现的文章中,亨利·福特健康胰腺癌中心的研究人员发现,黑人患者的PD-L1过表达的患病率更高,这是一种与侵略性癌症行为有关的标记,并且是免疫治疗的关键目标。与白人患者相比,黑人患者显示出更高的TP53突变和KRASG12R突变的频率。这些基因会影响癌症的生长速度和人体对抗癌症的能力。
用双重方法转化胸腺癌处理
Shukuya博士解释说:“大理石研究取得了令人鼓舞的结果。中位随访时间为15.3个月,联合疗法的客观反应率为56%,中位前进 - 自由生存期(PFS)为9.6个月,表现优于历史化疗结果。疾病控制率达到98%,有56%的患者达到部分反应,42%保持稳定疾病。”
乳酸乳杆菌乳腺癌益生菌菌株在治疗铬酸盐诱导的皮炎
铬酸盐诱导的皮炎是一个重大的职业健康问题。铬酸盐(CR)抗乳糖酶鼠李糖菌株是从商业益生菌prepro和Hiflora中分离出来的。在13个耐CR的细菌分离株中,根据500 ug/ml的高铬酸盐耐药性选择了6种。选定的分离株进行生化和分子表征以及体内分析。DPC测定,以确定分离细菌的降低潜力。选定的分离株被鉴定为L. rhamnosus -L1(Pp493917),L。rhamnosus -L2(Pp493918),L。Rhamnosus-L3(PP493921)L。 Rhamnosus -L12(PP493923)。乳酸乳杆菌L1SHOSUS l1展示了对CR(VI)的最高耐药性,降低了潜在的56%。进行了体内实验,以评估分离的细菌菌株对小鼠皮肤的愈合作用,并用苏木精和曙红(H&E)染色,用于鉴定皮肤组织中严重的皮炎并评估益生菌菌株的治疗作用。使用生物信息学工具进行了鼠李乳杆菌的黄素还原酶蛋白的结构测定。这些工具预测了细菌CR(VI) - 氧化系统中黄素还原酶蛋白的基于结构的功能同源。由于其较高的铬酸盐耐药性和降低潜力,可有效地用于铬酸盐诱导的皮炎,可有效地用于乳酸酶乳酸乳酸酶乳酸乳腺乳酸乳酸乳酸酶。