XiaoMi-AI文件搜索系统
World File Search System通过浅的全基因组测序评估的循环肿瘤DNA的动态变化与NSCLC中检查点抑制剂的临床功效相关
针对PD-1/PD-L1轴的免疫检查点抑制剂(ICIS)是晚期非小细胞肺癌(NSCLC)患者的主要治疗选择,而无需吸毒致癌性改变。尽管如此,只有一部分患者受益于这种治疗。在这里,我们评估了浅层全基因组测序(SWG)对等离子体样品的值,以监测ICI的好处。我们将SWG应用于从45例用ICIS治疗的转移性NSCLC患者的血浆样品中提取的无细胞DNA(CFDNA)。在ICI治疗开始之前,在整个治疗过程中获得了150多个样品。从SWGS数据中,我们计算了肿瘤分数(TFX)和体拷贝数变化(SCNA)负担,并将其与ICI的有益和临床特征相关联。TFX与骨骼和肝脏的转移性病变相关,与ICI有益相关的高TFX(≥10%)相关。此外,无论基线时TFX水平如何,其在治疗样品中的评估能够更好地预先临床效率。最后,对于可以计算出SCNA负担的患者的一部分,负担增加与ICI治疗后的好处减少相关。因此,我们的数据表明,SWG对CFDNA的分析可以以具有成本效益的方式对ICI的两种潜在生物标志物(TFX和SCNA负担)进行构成,从而促进了多个串行样本分析。将需要较大的队列来确定其临床潜力。
cr(vi)使用双室微生物燃料电池
抽象的铬离子显然是危险的重金属,由于其有毒和致癌性,尤其是其六价形式CR(VI)。主要的CR(VI)污染源之一来自电镀工业废水,如果不仔细治疗,则可能含有高浓度,会构成对水生和土壤生态系统污染的风险。通过使用微生物燃料电池(MFC),已知能够处理CR(VI)废水的替代方法之一。这项研究的重点是使用4L双室MFC从喂养批次条件下除去合成电镀废水,并研究了混合液体悬浮固体(MLSS)和化学氧气需求(COD)浓度(COD)浓度对其性能的影响。观察到的参数包括CR(VI)去除和功率密度的效率。分离污泥和乙酸盐分别用作生物质和底物来源。基于这项研究,可以得出结论,使用特定的MLS和COD浓度实现了最高的CR(VI)去除效率和功率密度,从而导致F/M比为0,459至0,489 GCOD/GCOD/GMLSS。从最初的Cr(VI)浓度为50 mg/l,通过MFC运行的最高MFC以初始MLSS和COD浓度分别为3.500和1.500 mg/L,在312小时内实现了62,17%。此设置还产生了48,22 mW/m²的最高功率密度。
基于化学计量学的气相色谱-质谱分析研究人脑肿瘤组织中的农药代谢物,探讨农药暴露与中枢神经系统肿瘤风险因素之间的假定相关性
摘要:农药被广泛使用,导致人类持续接触农药,并可能对健康产生影响。一些与农业工作有关的接触与神经系统疾病有关。自 2000 年代以来,文献中对农药在中枢神经系统 (CNS) 肿瘤发生中的作用的假设进行了更详尽的记录。然而,儿童脑癌的病因仍然很大程度上未知。这项工作的主要目的是根据问卷调查和统计分析从突尼斯斯法克斯哈比卜·布尔吉巴医院中部神经外科住院患者收集的信息,评估农药暴露作为中枢神经系统肿瘤风险因素的潜在作用,这些患者在 2022 年 1 月 1 日至 2023 年 5 月 31 日期间住院。它还旨在通过气相色谱-质谱技术开发一种简单快速的分析方法,用于研究一些收集的人脑肿瘤组织中农药代谢物的痕迹,以进一步强调我们对农药暴露与脑肿瘤发展之间这种相关性的假设。选取有高风险暴露史的患者进行进一步分析。采用化学计量学方法来辨别病理组和对照组之间的内在差异,并通过鉴定导致这种差异的差异表达代谢物来确定有效分离。三个样本显示出农药代谢物的痕迹,这些代谢物大多在早期检测到。一名 10 岁儿童的组织病理学诊断为髓母细胞瘤,27 岁和 35 岁成人的组织病理学诊断为高级别胶质瘤。双变量分析(比值比 >1 和 P 值 <5%)证实了暴露病例患癌症的可能性很大。Cox 比例风险模型显示,50 岁以后的致癌风险是农药毒性的长期影响。我们的研究支持农药暴露与人类脑肿瘤发展风险之间的相关性,表明孕前农药暴露,以及可能的怀孕期间的暴露,与儿童脑肿瘤风险增加有关。这一假设在鉴定出以神经毒性著称的氨基甲酸酯类杀虫剂代谢物痕迹以及以致癌性著称的哒嗪酮、有机氯 (OCs)、三唑类杀菌剂和 N-亚硝基化合物等代谢物痕迹后得到了进一步证实。2D-OXYBLOT 分析证实了杀虫剂的神经毒性作用,可诱导中枢神经系统细胞氧化损伤。在应激降解研究中鉴定出肟代谢物,证实了涕灭威具有脑致癌性。揭示 OC 类“氮丙啶”代谢物可能更好地强调了在早期检测农药代谢物痕迹的理论。总体而言,我们的研究结果促使我们建议限制农药在住宅中的使用,并支持为实现这一目标而制定的公共卫生政策,我们需要在上市后对人类健康影响的监测中保持警惕。
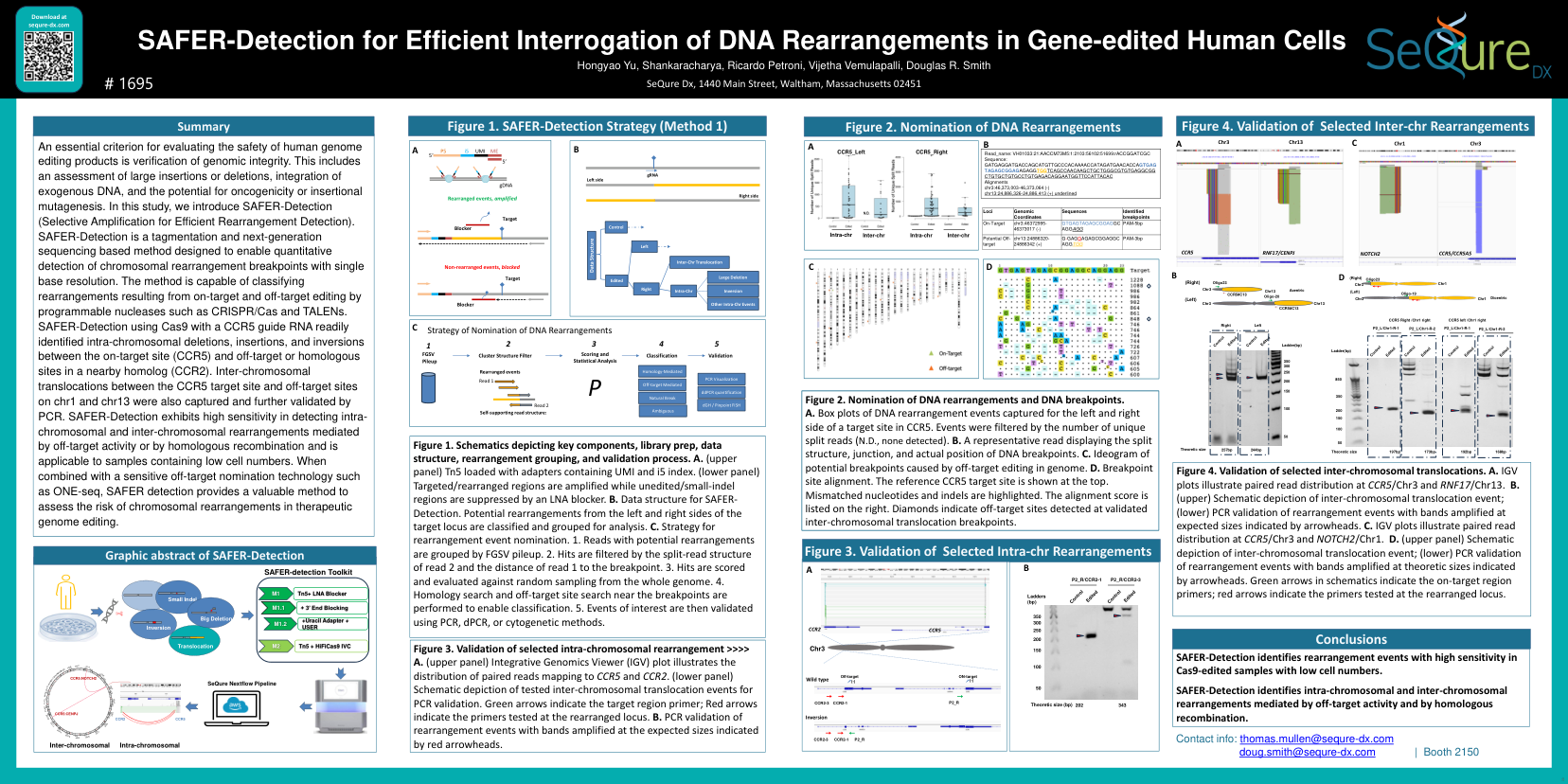
SAFER-Detection 用于有效检测基因编辑人类细胞中的 DNA 重排
评估人类基因组编辑产品安全性的一个重要标准是验证基因组完整性。这包括对大量插入或缺失、外源 DNA 整合以及致癌性或插入诱变可能性的评估。在本研究中,我们介绍了 SAFER-Detection(高效重排检测的选择性扩增)。SAFER-Detection 是一种基于标记和下一代测序的方法,旨在以单碱基分辨率定量检测染色体重排断点。该方法能够对由可编程核酸酶(如 CRISPR/Cas 和 TALEN)进行的靶向和脱靶编辑导致的重排进行分类。SAFER-Detection 使用 Cas9 和 CCR5 向导 RNA,可轻松识别靶位点 (CCR5) 与附近同源物 (CCR2) 中的脱靶或同源位点之间的染色体内缺失、插入和倒位。CCR5 靶位点与 chr1 和 chr13 上的脱靶位点之间的染色体间易位也被捕获并通过 PCR 进一步验证。SAFER-Detection 在检测由脱靶活动或同源重组介导的染色体内和染色体间重排方面表现出高灵敏度,适用于含有低细胞数的样本。当与灵敏的脱靶提名技术(如 ONE-seq)结合使用时,SAFER 检测提供了一种评估治疗性基因组编辑中染色体重排风险的宝贵方法。
药品名称:Abemaciclib
特殊人群: • 与白种人患者相比,东亚患者出现不良事件的频率可能更高2 • 与年轻患者相比,65 岁或以上的患者可能出现更多的血液学不良事件、低钾血症、低钙血症和严重感染2 致癌性:未发现信息 致突变性:Ames 试验中无致突变性。在哺乳动物体外和体内染色体试验中,Abemaciclib 无致染色体断裂现象。2,6 生育力:在动物研究中,在男性受试者中,当剂量高达人类所用剂量的两倍时,观察到精子减少症和睾丸、附睾、前列腺和精囊萎缩/变性/坏死。未观察到对女性生殖器官的影响。2,6 怀孕:在动物研究中,在器官形成期间给予 abemaciclib 时,母体暴露量大约等于按照推荐剂量预期的人类暴露量,则具有致畸性。研究结果包括胎儿体重下降以及心血管和骨骼畸形和变异的发生率增加。对于有生育能力的女性,建议在开始治疗前进行妊娠测试。在治疗期间以及最后一次服药后至少三周内应采取避孕措施。2,6 不建议母乳喂养,因为药物可能会分泌到乳汁中。在治疗期间以及最后一次服药后至少三周内不要母乳喂养。2,6
遗传与分子毒理学
N-亚硝胺药物杂质是FDA关注的重点,尤其是由药物本身形成的亚硝胺杂质,称为N-亚硝胺药物相关杂质或NDSRI。杂质可以在药物生命周期的任何时间形成,例如作为合成副产物、在储存过程中以及在接受治疗的患者体内产生的NDSRI。使用突变试验可以识别可能增加癌症风险的N-亚硝胺杂质;具有致突变性的N-亚硝胺被认为是致癌物质,在药物中的含量被控制在非常低的水平。因此,FDA开发能够识别致突变N-亚硝胺的测试模型非常重要。DGMT科学家与药物评估和研究中心(CDER)亚硝胺药物杂质工作组合作,使用体外细菌和人类细胞突变试验评估一系列小分子N-亚硝胺和NDSRI的致突变性和遗传毒性。此外,还使用二维 (2D) 和三维 (3D) 人类肝细胞 (HepaRG) 模型测试了八种不同的 N-亚硝胺的遗传毒性。最后,对不同的 N-亚硝胺在转基因啮齿动物中的致癌性进行了评估。这些研究的目的是开发筛选和后续检测方法,以高置信度确定 N-亚硝胺药物杂质的癌症风险。以下出版物描述了这些研究的结果:Regul Toxicol Pharm 和 Arch Toxicol。
制药技术百科全书
第 1 卷 21 CFR 第 11 部分回顾 / 1 吸收促进剂 / 13 药物吸收 / 19 固体表面吸附:制药应用 / 34 药物不良反应 / 46 处方药和非处方药产品的广告和促销 / 57 替代药物 / 66 无定形制药系统 / 83 分析程序:验证 / 92 药物开发中的动物 / 114 无菌处理:验证 / 127 自氧化和抗氧化剂 / 139 生物可吸收聚合物 / 155 药物的生物利用度和生物等效性 / 164 可生物降解聚合物作为药物载体 / 176 生物液体:分析 / 194 生物药剂学 / 208 药物的生物合成 / 228 生物技术和生物制剂 / 258生物技术衍生的药物产品:配方开发 / 281 生物技术衍生的药物产品:稳定性测试、灌装和包装 / 302 药物的生物转化 / 310 蒸汽灭菌的生物验证 / 325 血液替代品:氟碳方法 / 335 血液替代品:基于血红蛋白的氧载体 / 353 吹灌封:高级无菌处理 / 378 缓冲剂、缓冲剂和离子平衡 / 385 药物研发中的量热法 / 393 硬胶囊 / 406 软胶囊 / 419 致癌性测试:过去、现在和未来 / 431 手性分析方法 / 445 色谱分析方法:气相色谱法 / 463 色谱分析方法:高效液相色谱法
降低硝化原理及其机制的进步:教程评论
硝化化合物,在许多工业应用中被广泛用作必需的化学中间体,由于其致癌性,诱变性和致病性特性而构成了明显的环境和健康风险。这些化合物是最持久的污染物之一,为环境修复提供了主要的挑战。传统的去除方法,例如吸附,臭氧化,生物修复和电化学过程,是有效的,特别是对于大规模应用。室温催化减少的最新进展是一种有希望的替代方案,这主要是由于其有效性和所得产物的相对较低的氨基苯酚(AP)的毒性相对较低,这是一种有价值的化学物质。近期对工业废水的全面利用引起了极大的兴趣。因此,探索相关的还原技术,包括在水性生态系统中含有有害物质的废物的回收,不仅是最基本的环境问题,而且对经济绩效至关重要。氮气减少的传统方法o c涉及使用有毒试剂和高能消耗的过程,这会带来显着的环境危害。审查确定了当前理解中的重要差距,例如氢源在还原过程中的确切作用,并强调了该领域进一步探索的必要性。这些进步有可能改善工业过程的经济生存能力和环境可持续性,特别是在废水回收和减少污染的背景下。发展高度有效的可持续催化剂对于选择室温催化减少技术至关重要,这不仅解决了与危险的硝化化合物有关的环境问题,而且对工业废水管理的更广泛挑战有助于。
审查 - 生物修复在生物医学废物管理中的应用:当前和未来的前景
摘要:生物医学废物管理是医疗保健的组成部分,是医院清洁,卫生和维护活动的支柱。医疗护理对人类健康至关重要,但是生物医学废物的管理不善会损害地球上生态系统的动植物,并严重影响人类健康。由于其稳定性,生物医学废物不会被固体或污水处理厂消除,并在环境中被生物累积,并最终通过各种方式进入人口。由于其潜在的致癌性,遗传毒性,诱变性和其他毒性,它们是有害的。处置生物医学废物的当前处置技术是污水/排水,焚化和垃圾填埋场。这些做法通常是昂贵的,可能会将污染物从一种有毒形式转变为另一种有毒形式。生物修复是一种廉价的方法,它使用天然存在的微生物或植物将人造污染物排毒为无害的产物,这些污染物在此过程中也使土壤肥沃。研究人员还进化了基因工程的微生物,以补救包括放射性核素在内的环境污染物。植物修复也是一种可持续方法,在处理医院产生的重金属和放射性废物方面是合理且有能力的。在本文中,我们总结了使用有效的微生物和植物的生物修复技术的合理应用,以增强清除包括生物医学废物在内的几种顽固污染物。我们的评论重点介绍了生物化非生物降解和潜在有毒医院废物的挑战和未来观点。
人用疫苗注册指南
C.1 生物原料 ................................................................................................................................................ 4 C.2 流程图 .......................................................................................................................................................... 4 C.3 细胞的起源和来源 ........................................................................................................................................ 5 C.3.1 人类细胞 ................................................................................................................................................ 5 C.3.2 动物细胞 ................................................................................................................................................ 5 C.3.3 病毒/B 菌/其他来源 ................................................................................................................................ 6 C.3.4 微生物细胞 ................................................................................................................................................ 7 C.4 细胞历史 ................................................................................................................................................ 7 C.5 细胞基质的生成 ........................................................................................................................................ 8 C.6 细胞 B C.6.1 主细胞库 ...................................................................................................................................................... 10 C.6.2 工作细胞库 ...................................................................................................................................................... 10 C.6.3 原始细胞库 ...................................................................................................................................................... 11 C.6.4 二倍体细胞系 ...................................................................................................................................................... 11 C.6.5 肿瘤发生细胞系 ............................................................................................................................................. 12 C.7 细胞存库程序 ...................................................................................................................................................... 13 C.8 细胞库的特性分析和测试 ............................................................................................................................. 14 C.8.1 身份和纯度测试 ................................................................................................................................................. 15 C.8.2 细胞底物稳定性测试 ............................................................................................................................. 17 C.8.3 细胞核学和致瘤性测试 ............................................................................................................................. 19 C.8.4 致癌性测试 ............................................................................................................................................. 21 C.9 种子 ............................................................................................................................................................. 21 C.9.1 主种子 ............................................................................................................................................................. 23 C.9.2 工作种子 ............................................................................................................................................. 23 C.10 遗传构建体和重组细胞系 ............................................................................................................................. 24 C.10.1 宿主细胞 ............................................................................................................................................. 24 C.10.2 基因C.10.3 载体 ................................................................................................................................................................ 24 C.10.4 最终基因构建 ................................................................................................................................................ 24 C.10.5 重组细胞系的克隆和建立 ................................................................................................................................ 25 C.11 细胞生长和收获 ...................................................................................................................................................... 25 C.11.1 繁殖 ................................................................................................................................................................ 25 C.11.2 收获 ................................................................................................................................................................ 26 C.12 激活、纯化和下游加工 ................................................................................................................................ 26 C.12.1 激活 ................................................................................................................................................................ 27 C.12.2 净化...................................................................................................................................................... 28 C.12.3 稳定性处理 ...................................................................................................................................... 28 C.12.4 脱毒 ...................................................................................................................................................... 29