XiaoMi-AI文件搜索系统
World File Search System疫苗主题专家委员会 (SEC) 会议纪要,审查印度药品管理局关于生物制品问题的提案和建议
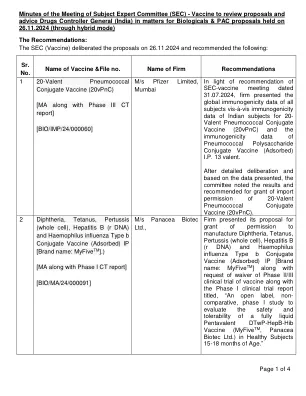
根据 2024 年 7 月 31 日 SEC 疫苗会议的建议,公司提交了所有受试者的全球免疫原性数据,以及印度受试者的 20 价肺炎球菌结合疫苗 (20vPnC) 的免疫原性数据和肺炎球菌多糖结合疫苗 (吸附) IP 13 价的免疫原性数据。经过详细审议并根据提交的数据,委员会注意到了结果并建议授予 20 价肺炎球菌结合疫苗 (20vPnC) 的进口许可。 2 白喉、破伤风、百日咳(全细胞)、乙型肝炎(r DNA)和b型流感嗜血杆菌结合疫苗(吸附)IP [品牌名称:MyFive TM 。)[MA 以及 I 期 CT 报告] [BIO/MA/24/000091]
制药业革命:揭开制药行业的人工智能和法学硕士趋势
与研发工作相辅相成的是“制造”领域,其中精确和标准化的流程被一丝不苟地执行。制造在确保药品的可重复性和质量方面发挥着关键作用。2 此外,“质量控制”程序在维持整个制造过程中的最高标准方面发挥着关键作用。3 同时,制药行业在严格的监管框架内运作,以维护安全性和有效性标准。法规遵从是该行业的基石,食品药品管理局 (FDA) 和欧洲药品管理局 (EMA) 等机构负责监督产品审批。同时,各种支持功能,例如“供应链优化”,确保及时将药品交付给患者。制药行业具有多面性,并且始终致力于研究、质量、监管和供应链效率,是创新的灯塔,也是推动全球医疗保健发展的驱动力。在这个充满活力的环境中,人工智能 (AI) 和大型语言模型 (LLM) 的出现标志着一个变革时代的到来,提供了前所未有的能力来重塑制药行业的各个方面。4
GAO-21-107,药品定价计划:卫生和公共服务部使用多种机制帮助确保遵守 340B 要求
340B 药品定价计划 (340B 计划) 要求药品制造商以折扣价向受保实体(符合条件的医院和参与该计划的其他实体)出售门诊药品,以便他们的药品可以享受医疗补助。参与 340B 计划的受保实体从 2010 年的近 9,700 个增加到 2020 年的 12,700 个。卫生与公众服务部 (HHS) 的卫生资源和服务管理局 (HRSA) 负责管理该计划,并通过年度审计等方式监督受保实体是否遵守 340B 计划的要求。如果审计发现不符合计划要求的情况,HRSA 会向受保实体发布调查结果,并要求他们采取纠正措施以继续参与 340B 计划(见表格)。
加密资产活动和市场的监管、监督和监督
7 月 11 日,金融稳定理事会发布了一份公开通讯,强调加密资产可能带来的风险和威胁;强调加密资产活动并非在不受监管的空间中运作;对不符合现有标准、适用规则和法规表示担忧;并指出,除非任何此类服务提供商符合所有适用的监管要求,否则加密资产提供商不得在任何司法管辖区开展业务。该通讯还重申了金融稳定理事会在促进司法管辖区金融当局和国际标准制定机构之间的合作方面的作用,以确保加密资产活动和市场受到与其可能带来的风险相称的有效监管和监督,同时支持负责任的创新并为各司法管辖区实施国内方法提供足够的灵活性。
指南草案:药物(包括生物制品)儿科研究的一般临床药理学考虑
1 本指南由临床药理学办公室儿科工作组与食品药品管理局药品评价与研究中心医疗政策协调委员会儿科小组委员会联合制定。 2 在本指南中,申办者一词指申办者和申请人。 3 在本指南中,药品包括根据联邦食品药品监督管理局法案第 505 节(21 USC 355)批准的药品和根据 PHS 法案第 351(a) 节(42 USC 262(a))许可并作为药品进行监管的生物制品。此后,药品一词将用于指代所有此类产品。 4 本指南适用于根据 PHS 法案第 351(a) 节提交的 BLA。有关机构对根据第 351(k) 节提交的 BLA 的临床药理学考虑事项的想法,请参阅 FDA 指南《支持与参考产品生物相似性的临床药理学数据》(2016 年 12 月)。我们会定期更新指南。如需获取指南的最新版本,请查看 FDA 指南网页 https://www.fda.gov/RegulatoryInformation/Guidances/default.htm 。此外,有关生物仿制药申请背景下的儿科研究公平法案 (PREA)(FD&C 法案第 505B 节)的信息,请参阅 FDA 指南《生物仿制药开发和 BPCI 法案问答(修订版 2)》(2021 年 9 月)。
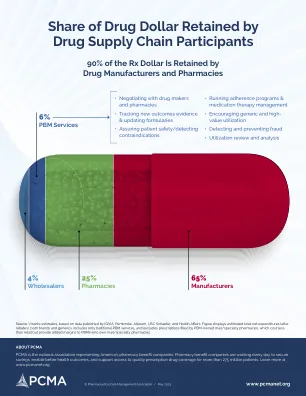
药品供应链参与者保留的药品金额份额
资料来源:Visante 估计,基于 IQVIA、Pembroke、Altarum、USC Schaefer 和 Health Affairs 发布的数据。该图显示了估计的总净支出(扣除回扣后),包括品牌药和仿制药。仅包括传统的 PBM 服务,不包括 PBM 拥有的邮寄/专科药房配发的处方,这些处方的成本低于零售,但为拥有邮寄/专科药房的 PBM 提供了额外的利润。
根据欧盟法规第 726/2004 号第 57(2) 条,有关上市许可持有人向欧洲药品管理局以电子方式提交人用药品信息的详细指南
2.1. 药物警戒合格人员(QPPV)的维护 ...................................................................... 160 2.1.1. 通知 QPPV 详细信息变更的业务流程 .............................................................................. 160 流程图 3 – QPPV 详细信息的变更 ...................................................................................... 161 2.1.2. 通知 QPPV 变更的业务流程 ...................................................................................... 161 流程图 4 – QPPV 变更 ...................................................................................................... 163 2.2. 营销授权持有人(MAH)组织实体的维护 ............................................................................. 165 2.2.1. 通知 MAH 的联系方式、名称和/或地址的变更(即,法人实体未发生变更) ................................................................................................................ 165 2.2.2. 2.4. 授权转让通知(即法人实体变更) 165 流程图 5 – MAH 详细信息变更 .............................................................................. 167 流程图 6 – 将 MAH 实体通知为“非现行” ...................................................................... 168 2.3. 药物警戒系统主文件位置(PSMFL)实体的维护 ............................................................. 170 流程图 7 – PSMF 信息变更 ...................................................................................... 172 流程图 8 – 将 PSMFL 实体通知为“非现行” ............................................................................. 173 2.4. 授权药品(AMP)实体的维护 ............................................................................. 175 流程图 9 – 根据监管程序修改 XEVMPD 中的药品信息的业务流程 ................................................................................................................ 176 流程图 10 – 修改 AMP 实体 ............................................................................................. 177 2.4.1.营销授权变更 ................................................................................................................ 178 2.4.1.1. 业务流程 - 变更后授权编号已更改 ........................................................................ 183 2.4.1.2. 业务流程 - 变更后授权编号未更改 ........................................................................ 183 2.4.2. 营销授权暂停(解除) ............................................................................................. 184 2.4.3. 营销授权转让 ............................................................................................................. 184 2.4.3.1. 在 EudraVigilance 注册的总部不同的组织之间的营销授权转让 ................ ...
改善获得药品的机会并促进药品创新
请愿人提出了Casu Marzu的案例,Casu Marzu是一种传统的撒丁奶酪,是根据世代相传的古代传统制作的,是意大利食品和葡萄酒遗产的独特部分。它的特殊特征是昆虫的幼虫Piophila Casei的存在,它在其独特的成熟过程中起着作用。由于幼虫的存在,奶酪的生产和营销以来,自2002年以来就被禁止在欧盟中,因为它被认为与意大利传统的意大利农业食品产品列表不符合《卫生法规》的有效法规,这是意大利的意大利农业,食品,食品和林业政策所认可的。请愿人呼吁欧盟机构仔细评估CASU MARZU是否可以将其作为可以在欧盟中生产的食物进行重新读到,并考虑清除当前的监管障碍,并提出确定了特定而严格的标签,标签和营销规则,从而维护消费者的健康和安全。
主持人和 Reactor 小组成员
Patrizia Cavazzoni 博士是美国食品药品管理局药品评估和研究中心 (CDER) 主任。该中心的使命是确保向公众提供安全、有效和高质量的药物。为实现这一目标,CDER 在其管辖范围内的整个生命周期内监管医疗产品,监督新药和仿制药的开发,评估申请以确定是否应批准药物,监控药品上市后的安全性,开展研究以推进监管科学,并采取执法行动保护公众免受有害产品的侵害。Cavazzoni 博士于 2018 年 1 月加入 FDA,担任 CDER 运营副主任,她代表该组织领导了多项重要举措。她还于 2019 年 1 月至 2019 年 2 月担任食品和药品代理副局长。
培训和监督计划
说明 本部分必须由申请人/候选人和在候选人资格期间负责监督申请人/候选人的主管填写并签字。如果申请人/候选人有多名主管,则必须为每位主管填写此表。已经获得执照但要更换和/或增加新主管的 LCPC 候选人必须在更换后 20 个工作日内提交一份新的监督协议,该协议也由新主管签字。您可以扫描此表格并将其直接上传到您的在线申请/帐户,或将其通过电子邮件发送至 dlibsdhelp@mt.gov。第 1 部分 - 申请人/候选人信息 1. 申请人/候选人全名:名字 中间名 姓氏 2. 申请人/候选人邮寄地址: 3. 申请人/候选人电子邮件地址: 第 2 部分 - 监督员 4. 监督员全名:名字 中间名 姓氏 5. 监督员执照名称:(例如 LCSW、LCPC、LMFT、执业心理学家或执业并获得委员会认证的精神科医生) 6. 监督员执照编号: 第 3 部分 - 声明 我,即 LCPC 申请人/候选人了解根据 [ ARM 24.219.421 ] 和 [ ARM 24.219.422 ] 的监督经验和记录保存的要求。申请人/候选人法定签名 日期 我,候选监督员了解 ARM 24.219.421 中监督经验和记录保存的要求,并符合 ARM 24.219.422 中规定的监督资格。 监督员法定签名 日期