XiaoMi-AI文件搜索系统
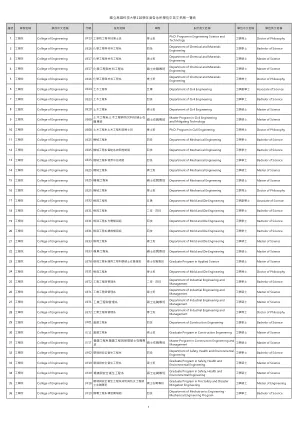
World File Search System国立高雄科技大学110学年度各系所学位中英文名称一览表
46 电机与资讯学院College of Electrical Engineering and Computer Science UB02 电机工程系智慧自动化系统硕士在职专班硕士在职专班Graduate Program in Intelligent Automation Systems 工学硕士Master of Science
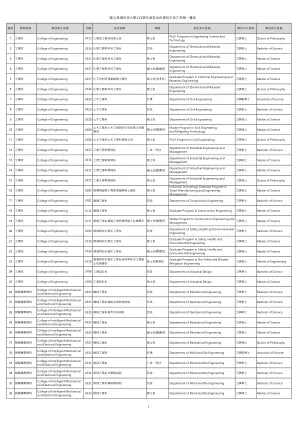
国立高雄科技大学111学年度各系所学位中英文名称一览表
41 智慧机电学院College of Intelligent Mechanical and Electrical Engineering UF11 机电工程系智慧自动化组四技Department of Mechatronics Engineering- Automation Engineering Program 工学学士Bachelor of Science
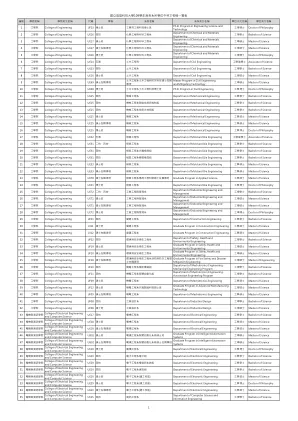
国立高雄科技大学109学年度各系所学位中英文名称一览表
47 电机与资讯学院College of Electrical Engineering and Computer Science UB02 硕士在职专班电机工程系智慧自动化系统硕士在职专班Graduate Program in Intelligent Automation Systems 工学硕士Master of Science
数量 1 单位 1 名称
(7)其他 A.须在投标开始前提交《资格审查结果通知书》一份。若您已经提交过,则无需再次提交。 若申请人由代表人或其他代理人代为竞投,则其须于竞投开始前提交《授权委托书》。 邮寄投标应清楚写明公司名称、投标日期和时间、投标主题,并用红色写明“投标书已附上”,并于7月24日星期三下午5点之前邮寄到下述地址。此外,投标人还将提前通过邮件收到投标意向通知。 如果您希望参加投标,您必须于7月18日星期四下午3点之前通过传真或其他方式提交市场价格调查文件。 投标人必须提交“驻军使用标准合同”和“投标和合同指南”(可在东部陆军会计团网站https://www.easternarmy.gov/上获取)。「go jp/gsdf/eae/kaikei/eafin/index html」或泷原警备队会计局办公室。 通过提交您的出价,您将被视为承诺遵守“关于排除有组织犯罪集团的承诺”。投标文件中应当包含下列声明作为接受的表示: “本公司(本人(若为个人)、本公司(若为团体))承诺遵守本承诺书中关于排除有组织犯罪的事项”。若拒绝提交上述“排除有组织犯罪承诺事项”的承诺书,则无法参加投标。若在初次投标时有通过邮寄方式提交的投标人,则重新投标的时间如下。
靶向疫苗表位
免疫原性表位的计算预测是治疗和预防疫苗设计的有前途的平台。该策略的一个潜在目标是人类免疫缺陷病毒 (HIV-1),尽管经过数十年的努力,但尚未有可用的疫苗。特别是,设计用于消除受感染细胞的治疗性疫苗将成为治愈策略的关键组成部分。最近,基于 HIV/AIDS 患者个体病毒免疫学数据设计的 HIV 肽显示出能够诱导治疗后病毒设定点的消退。然而,这种方法的可重复性和可扩展性受到与手动肽设计相关的错误和任意性以及耗时过程的限制。我们在此介绍 Custommune,这是一种用户友好的网络工具,用于设计个性化和针对人群的疫苗。当应用于 HIV-1 时,Custommune 使用患者特定的人类白细胞抗原 (HLA) 等位基因和病毒序列以及预期的 HLA 肽结合强度和潜在的免疫逃逸突变来预测个性化表位。值得注意的是,Custommune 预测结果与最近 II 期临床试验 (NCT02961829) 中施用的手动设计肽相比更为有利。此外,我们利用 Custommune 设计了针对受 COVID-19 影响严重的人群的预防性疫苗。结果允许识别针对每个人群量身定制的肽,并预测会引发 CD8 + T 细胞免疫和针对严重急性呼吸综合征冠状病毒 2 (SARS-CoV- 2) 结构保守表位的中和抗体。总体而言,我们的数据描述了一种快速开发针对慢性和急性病毒感染的个性化或基于人群的免疫疗法的新工具。介绍
识别B型表位
b细胞是自适应免疫系统的关键组成部分,并且在通过产生浆细胞和记忆细胞实现的病原体的长期病原体方面起着关键作用。浆细胞具有称为抗体的特定受体,这是体液免疫反应中抗原 - 抗体(AG -AB)相互作用的重要组成部分。尽管抗原通常更大,但抗体或B细胞受体特异性识别并与称为抗原决定剂或表皮的某些抗原区域结合(Jespersen等,2019)。抗体通过与它们的结合位点或副型的相互作用来识别这些区域,并在引发免疫反应中起着至关重要的作用(Jespersen等,2019)。因此,准确表征和识别B细胞表位(BCE)是用于开发基于表位的疫苗(Russi等,2018),疾病预防和免疫学诊断工具(Schellekens等人,2000年)。值得注意的是,已经表现出很高效力,选择性和安全性的治疗性抗体已在文献中进行了广泛的研究和报道(Kam等,2012; Manavalan等,2018; Potocnakova et al。bces是表面加速的氨基酸簇,基于它们的规范结构属于两个主要类别:连续(线性或顺序)和不连续(非线性或构象)(Atassi&Smith,1978; Jespersen et al。,2019; Potocnakova et al。,2016年)。序列决定了与顺序表位的抗体结合,并且不取决于抗原的三级结构。因此,顺序表位是称为抗原区域的蛋白质的小段。相反,与构象表位结合的抗体依赖于抗原的三维(3D)结构(Benjamin等,1984; Gershoni等,2007; Kulkarni- Kale等,2005)。大约90%的总BCE是不连续的,这意味着该序列中的残基彼此遥远,并通过蛋白质折叠在附近靠近,形成了功能性抗原性决定因素(Kringelum等,2013)。因此,没有关于AG - AB复合物的准确的高分辨率结构信息,而是识别停药的表位是具有挑战性的(Haste Andersen等,2006; Najar等,2017)。研究还表明,几组连续的表位毗邻与停止表位相邻,这模糊了连续和不连续的表位之间的界线(Galanis等,2021; Van Regenmortel,2006)。准确确定共同的BCES高度取决于抗原的3D结构(Jespersen等,2019; Raoufi等,2020; Sharon等,2014)。在下一代测序时代,由于测序技术的进步,已经对许多病原体进行了测序。需要在
研究费の取扱区分表(大项目・中项目一覧表)
。 《竞争性基金间接费用执行通用指南》(有关部委竞争性研究基金联络委员会2001年4月20日通过(请参阅最新版本)) 可用于附表1所列费用*计算间接费用时,不足1日元的小数部分向下舍入。
科研经费分类表(大项/中项列表)
。 《竞争性基金间接费用执行通用指南》(有关部委竞争性研究基金联络委员会2001年4月20日通过(请参阅最新版本)) 可用于附表1所列费用*计算间接费用时,不足1日元的小数部分向下舍入。