XiaoMi-AI文件搜索系统
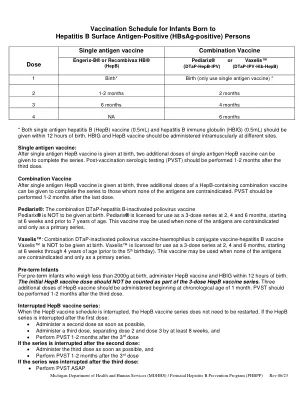
World File Search System乙肝表面抗原阳性(HBsAg阳性)人士所生婴儿的疫苗接种时间表
Pediarix®:DTaP-乙肝灭活脊髓灰质炎病毒联合疫苗 Pediarix ® 不得在出生时注射。Pediarix ® 被批准在 2、4 和 6 个月时作为 3 剂系列使用,从 6 周开始直到 7 岁之前。当没有任何抗原禁忌时,可以使用这种疫苗,并且只能作为基础系列。Vaxelis™:DTaP-灭活脊髓灰质炎病毒疫苗-乙型嗜血杆菌结合疫苗-乙肝疫苗联合疫苗 Vaxelis™ 不得在出生时注射。Vaxelis™ 被批准在 2、4 和 6 个月时作为 3 剂系列使用,从 6 周开始直到 4 岁(5 岁生日之前)。当没有任何抗原禁忌时,可以使用这种疫苗,并且只能作为基础系列。早产儿 出生时体重不足 2000 克的早产儿,应在出生后 12 小时内接种乙肝疫苗和乙肝免疫球蛋白。初次接种的乙肝疫苗剂量不应计入 3 剂乙肝疫苗系列中。应从 1 个月大开始接种另外 3 剂乙肝疫苗。PVST 应在第三剂后 1-2 个月进行。中断的乙肝疫苗系列:当乙肝疫苗接种计划中断时,无需重新开始乙肝疫苗系列。如果在第一次接种后中断乙肝疫苗系列:
Flucelvax Tetra,Inn-Influenza疫苗(表面抗原,灭活,在细胞培养物中制备)
B/Phuket/3073/2013类菌株(B/Singapore/Inftt-16-0610/2016,野生型)15微克ha ** ha **每0.5 ml剂量……………………………………………………………………………………………………………………。*在Madin Darby Canine肾脏(MDCK)细胞中繁殖**血凝素蛋白疫苗符合世界卫生组织(WHO)推荐(WHO)建议(北半球)和欧盟2023/2024季节的建议。Flucelvax Tetra可能包含β-丙二醇,溴化甲基三甲基铵和多山甲基甲基甲基苯二甲酸酯和多山眼虫80的痕迹(请参阅第4.3节)。有关赋形剂的完整列表,请参见第6.1节。3。药物形式的注射悬浮液(注射)至略微蛋白浆液体。4。临床细节4.1成人和2岁儿童中流感的治疗适应症。应根据官方建议使用flucelvax Tetra。4.2第二名成年人和2岁的儿童的职业和行政方法
澳大利亚产品信息 TWINRIX (720/...
TWINRIX 是使用在人类细胞培养物 (MRC5) 中生长的 HM 175 甲型肝炎病毒株配制而成,并用甲醛灭活。乙型肝炎表面抗原 (rys) 成分是通过培养基因工程酿酒酵母细胞 (面包酵母) 产生的,该酵母细胞携带乙型肝炎病毒表面抗原 adw 亚型的相关基因。甲型肝炎病毒抗原和乙型肝炎表面抗原 (rys) 均通过几个物理化学步骤纯化,并配制成吸附在铝盐上的单独抗原悬浮液。TWINRIX 是通过汇集纯化抗原的批量制剂生产的。批量甲型肝炎病毒抗原和乙型肝炎表面抗原 (rys) 制剂与目前许可的单价甲型肝炎 (Havrix) 和乙型肝炎 (Engerix-B) 疫苗制造中使用的制剂相同。标准化发酵和纯化程序确保批次之间的一致性。该疫苗与人体血液或血液制品无关。
PRAC 议程草案 2025 年 2 月 10 日至 13 日
6.1.37. 大流行性流感疫苗(H5N1)(表面抗原,灭活,佐剂化,在细胞培养中制备)- INCELLIPAN (CAP);人畜共患流感疫苗(H5N1)(表面抗原,灭活,佐剂化,在细胞培养中制备)- CELLDEMIC (CAP) - PSUSA/00011057/202407 .... 32
克罗地亚西部成年人隐匿性乙型肝炎病毒感染的流行情况和乙型肝炎表面抗原突变体的特征
简介和目标:隐匿性乙型肝炎病毒 (HBV) 感染 (OBI) 的特征是,乙型肝炎表面抗原 (HBsAg) 阴性患者的血液/肝脏中乙型肝炎病毒 (HBV) DNA 含量较低。本研究旨在确定血清学特征为“仅抗 HBc”的患者中的 OBI 患病率和病毒学特征(病毒基因型和 HBsAg 突变体)。材料和方法:在五年期间,共对 24 900 份血清样本进行了常规乙型肝炎标志物筛查。选择所有抗 HBc 阳性/HBsAg 阴性/抗 HBs 阴性血清并分析 HBV DNA 的存在情况。对 HBs 基因和聚合酶基因序列进行了突变分析。结果:1749 份(7.02%)血清呈抗 HBc 阳性,113 份(0.45%)血清具有“仅抗 HBc”血清学特征(HBsAg/抗 HBs 阴性)。113 份(10.61%)“仅抗 HBc”阳性血清中有 12 份检测到 HBV DNA,占所有常规检测样本的 0.048%。由于病毒血症极低,仅在两份确认为 D3 亚型的血清中成功测序了 HBV 基因组。S 基因突变分析显示存在多个错义突变。除了与诊断逃逸相关的 M133I、Y134F 和 G145R 突变外,我们还发现了九种新的 OBI 相关 S 基因突变 - S136Y、F158L、K160N、E164G、S167L、A168V、L175S、S210I 和 F212C。结论:我们在 2/12 (16.6%) OBI 病例中检测到多个已知和新的 S 基因突变,尽管如此,仍需要进一步研究以确定它们在 OBI 发病机制中的作用。了解临床相关 HBV 突变的频率可能有助于改进诊断方案。 © 2023 Fundación Clínica Médica Sur, AC 由 Elsevier España, SLU 出版 这是一篇在 CC BY-NC-ND 许可下的开放获取文章 ( http://creativecommons.org/licenses/by-nc-nd/4.0/ )
人畜共患流感疫苗 Seqirus,INN-人畜共患流感疫苗 (h5n8)(表面抗原,灭活,佐剂)
接种此疫苗前请仔细阅读本说明书,因为其中包含对您来说很重要的信息。 - 请保留本说明书。您可能需要再次阅读。 - 如果您有任何其他问题,请咨询您的医生或护士。 - 如果您出现任何副作用,请咨询您的医生或护士。这包括本说明书中未列出的任何可能的副作用。请参阅第 4 节。本宣传单包含的内容 1. 什么是佐剂型人畜共患流感疫苗 Seqirus H5N8 以及它用于什么 2. 在接种佐剂型人畜共患流感疫苗 Seqirus H5N8 之前您需要知道什么 3. 如何注射预充式注射器中的佐剂型人畜共患流感疫苗 Seqirus H5N8 悬浮液 4. 可能的副作用 5. 如何储存佐剂型人畜共患流感疫苗 Seqirus H5N8 6. 包装内容和其他信息 1. 什么是佐剂型人畜共患流感疫苗 Seqirus H5N8 以及它用于什么 佐剂型人畜共患流感疫苗 Seqirus H5N8 是一种供 6 个月及以上人群使用的疫苗,旨在在人畜共患流感爆发的情况下接种(即将推出)人类可以使用一种名为 Seqirus H5N8 的佐剂型人畜共患流感疫苗来预防由 H5 亚型甲型流感病毒引起的流感。人畜共患流感病毒偶尔会感染人类,可引起多种疾病,从轻度上呼吸道感染(发烧和咳嗽)到迅速发展为严重肺炎、急性呼吸窘迫综合征、休克甚至死亡。人类感染主要由接触受感染的动物引起,但不易在人与人之间传播。当预计可能因相同或相似毒株而发生大流行时,也应接种佐剂型人畜共患流感疫苗。接种疫苗后,免疫系统(人体的天然防御系统)会产生自身的保护作用(抗体)来对抗疾病。疫苗中的任何成分都不会引起流感。 2. 接种佐剂型人畜共患流感疫苗 Seqirus H5N8 前需要了解的事项 您不应接种佐剂型人畜共患流感疫苗 Seqirus H5N8: 如果您之前对佐剂型人畜共患流感疫苗 Seqirus H5N8 的任何成分(列于第 6 节)或任何可能以微量存在的物质有过突然危及生命的过敏反应,例如:鸡蛋和鸡蛋白、卵清蛋白、甲醛、卡那霉素和硫酸新霉素(抗生素)、氢化可的松或十六烷基三甲基溴化铵 (CTAB)。过敏反应的症状可能包括皮疹瘙痒、呼吸急促和面部或舌头肿胀。
已接种疫苗/需要后续治疗
*甲型肝炎:如果在农村和偏远的土著社区或与原住民或托雷斯海峡岛民儿童和/或发育障碍者一起参加实习,建议接种疫苗。**流感:建议季节性接种疫苗 *** 乙肝表面抗原:在乙肝流行国家/地区居住至少 3 个月的个人在接种疫苗前必须进行包括乙肝表面抗原在内的血清学检查。参见流行国家列表(中危和高危)。
全面的表面组分析以识别和...
抑制剂尚未显示出足够的抗肿瘤活性(4)。因此,迫切需要新的治疗策略。针对细胞表面抗原的免疫疗法,例如治疗性单克隆抗体(mAb)、嵌合抗原受体(CAR)T 细胞和免疫偶联物,例如抗体-药物偶联物(ADC),已在血液系统恶性肿瘤和实体肿瘤中显示出良好的疗效(5 – 7)。几种 mAb 和 ADC 已在骨肉瘤临床试验中进行了测试(8 – 12)。尽管发现 HER2、IGF1R、GD2 和 GPNMB 在一些骨肉瘤样本中表达(13 – 15),但这些靶标的 mAb 或 ADC 在临床试验中未能表现出足够的抗肿瘤活性(8、9、11、12)。一个潜在原因可能是表面抗原的表达水平低。理想情况下,用作免疫治疗靶点的细胞表面抗原应在肿瘤上具有高表达水平,而在正常组织上表达有限(13-16)。然而,骨肉瘤的表面组尚未得到充分研究。缺乏已知的肿瘤特异性细胞表面抗原一直是未来开发骨肉瘤治疗方法的主要障碍。在当前的研究中,我们试图识别在骨肉瘤中具有治疗潜力的可靶向细胞表面抗原。我们采用高通量集成方法,使用来自骨肉瘤细胞系、患者来源的异种移植(PDX)组织和患者样本的蛋白质组学和转录组学数据来识别高置信度的骨肉瘤细胞表面抗原。我们的数据表明,MT1-MMP (MMP14)、MRC2 (uPARAP/endo180) 和 CD276 (B7-H3) 在骨肉瘤中高度表达。目前,I/II 期临床试验 (NCT03486730) 正在探索 MT1-MMP 作为治疗靶点,联合使用自行车毒素偶联物 (BTC) BT1718。BTC 由受限的双环肽组成,这些肽对靶点具有低纳摩尔亲和力,并且与 ADC 一样,旨在在肿瘤微环境中释放细胞毒性有效载荷 (17)。与 ADC 相比,BTC 具有低分子量(4.5 kDa),这能够快速穿透肿瘤并缩短全身半衰期,从而有助于最大限度地降低毒性 (18)。然而,MT1-MMP 靶向治疗之前尚未在骨肉瘤中进行过测试。