XiaoMi-AI文件搜索系统
World File Search System利用 dCas9-VPR 进行遗传性失明的基因治疗——...
催化失活的 dCas9 与转录激活因子 (dCas9-VPR) 融合能够激活沉默基因。许多疾病基因都有对应基因,它们具有相似的功能,但在不同的细胞类型中表达。弥补缺陷基因缺失功能的一个有吸引力的选择是通过 dCas9-VPR 转录激活其功能等效的对应基因。这种方法的主要挑战包括 dCas9-VPR 的递送、激活效率、靶基因的长期表达以及体内的不良反应。使用表达分裂 dCas9-VPR 的双腺相关病毒载体,我们展示了在缺乏视紫红质的视网膜色素变性小鼠模型中有效转录激活和长期表达视锥细胞特异性 M-视蛋白 (Opn1mw)。治疗一年后,这种方法改善了视网膜功能,减轻了视网膜变性,没有明显的不良反应。我们的研究表明,dCas9-VPR 介导的功能等同基因的转录激活对于治疗遗传疾病具有巨大潜力。
GPCR A 家族药物的物理化学优化
1. 引言 GPCR(G 蛋白偶联受体)是最大的一类细胞外信号蛋白,可对由神经递质、离子、气味和其他刺激物组成的多种化学物质作出反应 [1]。大多数医学治疗靶点属于五大蛋白质家族之一,即 G 蛋白偶联受体 (GPCR)、离子通道、激酶、核激素受体和蛋白酶 [2]。G 蛋白偶联受体 (GPCR) 对各种生物功能至关重要,包括视觉、嗅觉和衰老。它们与各种人类病理生理状况(糖尿病、肥胖症、阿尔茨海默病和一些中枢神经系统疾病)有关,并且是治疗药物最重要的靶点之一 [2]。如图 1 所示,GPCR 主要根据其结构组成和相似性分为不同的家族 [3]。GPCR A 类(视紫红质样)仍然是其中最大的群体之一。事实上,GPCRs A 类靶向几乎占所有处方药的三分之一,因为它们中的大多数具有共同的激活机制 [4]。一种非常流行的寻找目标和线索的方法,其中有结构信息可用,称为基于片段的药物发现 (FBDD),用于筛选药物片段[5]。许多物理化学参数,如分子量、水溶性、可旋转键数和亲脂性值
基于双 AAV CRISPR-Cas9 的“...
mRho hRHO/+ 小鼠注射了双 AAV 系统,其中以不同的载体 1:载体 2 比例识别出领先的 gRNA 59,并在注射后 6 周进行分析(载体 n=12;gRNA 59 n=20–22)。显示平均值 (SD)。*p<0.05、**p<0.01、***p<0.001、****p<0.0001 vs 载体。# p<0.05、## p<0.01、#### p<0.0001 vs 其它载体比例。(A) 编辑标准化为转导区域。黑色虚线表示达到治疗相关编辑水平 (≥25%) 的阈值。3 (B) gRNA 水平。(C) Cas9 mRNA 水平。(D) 内源性 hRHO mRNA 水平。数据标签表示与载体相比的百分比下降。(E) 外源性替代 coRHO mRNA 水平。数据标签表示与载体相比的倍数增加。AAV,腺相关病毒;bp,碱基对;coRHO,密码子优化的RHO等位基因;gRNA,向导RNA;hRHO,人类RHO等位基因;mRho,小鼠Rho等位基因;NGS,下一代测序;RHO/Rho,视紫红质;SD,标准差。
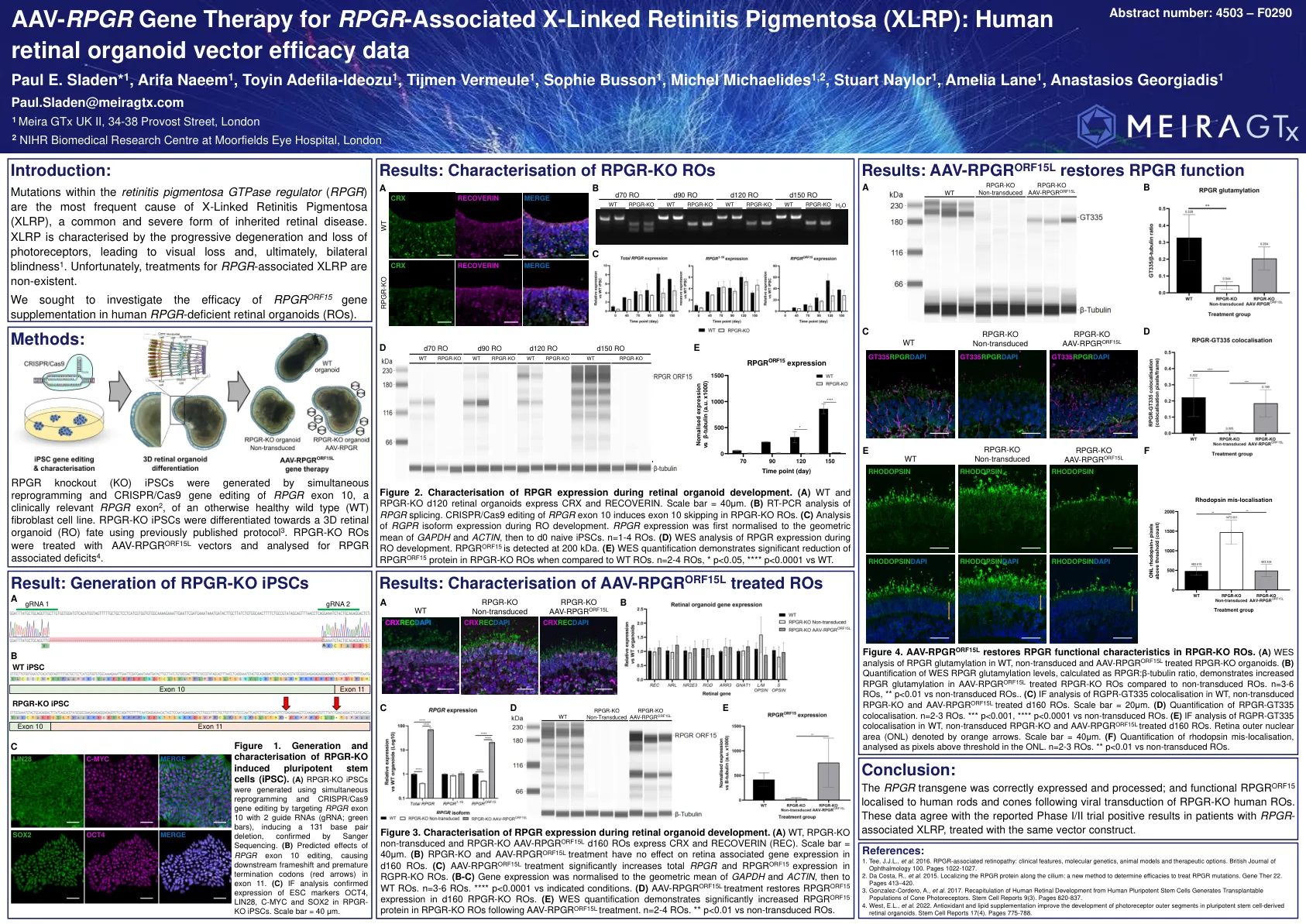
AAV-RPGR 基因治疗 RPGR 相关 X 连锁...
图 4. AAV-RPGR ORF15L 恢复 RPGR-KO RO 中的 RPGR 功能特性。(A)对 WT、未转导和 AAV-RPGR ORF15L 处理的 RPGR-KO 类器官中的 RPGR 谷氨酰化进行 WES 分析。(B)以 RPGR:β-微管蛋白比率计算的 WES RPGR 谷氨酰化水平量化表明,与未转导的 RO 相比,AAV-RPGR ORF15L 处理的 RPGR-KO RO 中的 RPGR 谷氨酰化增加。n=3-6 RO,** 与未转导 RO 相比 p<0.01。(C)对 WT、未转导的 RPGR-KO 和 AAV-RPGR ORF15L 处理的 d160 RO 中的 RGPR-GT335 共定位进行 IF 分析。比例尺 = 20μm。 (D) RPGR-GT335 共定位的量化。n=2-3 RO。*** p<0.001,**** p<0.0001 vs 非转导 RO。(E) WT、非转导 RPGR-KO 和 AAV-RPGR ORF15L 处理的 d160 RO 中 RGPR-GT335 共定位的 IF 分析。视网膜外核区域 (ONL) 以橙色箭头表示。比例尺 = 40μm。(F) 视紫红质错误定位的量化,分析为 ONL 中高于阈值的像素。n=2-3 RO。** p<0.01 vs 非转导 RO。
细胞特异性单病毒载体 CRISPR/Cas9 编辑和中枢及外周神经系统中的基因编码工具传递
(AAV)。为了克服这些限制,我们开发了一种替代基因编辑策略,使用单个 AAV 载体和表达 Cre 依赖性 Cas9 的小鼠系,实现整个神经系统内有效的细胞类型特异性编辑。从基因组位点表达 Cre 依赖性 Cas9 提供了空间,可以将用于基因编辑的指导 RNA 与 Cre 依赖性、遗传编码的工具一起包装在一起,以使用单个病毒来操纵、映射或监测神经元。我们用神经科学中的三种常见工具验证了这一策略:ChRonos(一种通道视紫红质),用于使用光遗传学研究突触传递,GCaMP8f 用于使用光度测定法记录 Ca 2+ 瞬变,以及 mCherry 用于追踪轴突投射。我们在多个脑区和细胞类型中测试了这些工具,包括伏隔核中的 GABA 能神经元、从腹侧苍白球投射到外侧缰核的谷氨酸能神经元、腹侧被盖区中的多巴胺能神经元和外周的本体感受神经元。这种灵活的方法可以帮助通过一次病毒注射识别和测试影响突触传递、电路活动或形态的新基因的功能。
CRISPR/Cas9 介导双等位基因 F0 海葵鱼 (Amphiprion ocellaris) 突变体的产生
基因组操作是一种有用的方法,可用于阐明发育、生理和行为方面的分子途径。然而,由于缺乏适用于珊瑚鱼的基因编辑工具,因此它们许多独特特征的遗传基础仍有待研究。一种适合应用这种技术的标志性珊瑚鱼群是海葵鱼 (Amphiprioninae),因为它们与海葵共生、雌雄同体、复杂的社会等级、皮肤图案发展和视觉,并且相对容易在水族箱中饲养,因此被广泛研究。在这项研究中,我们开发了一种基因编辑方案,用于将 CRISPR/Cas9 系统应用于眼斑海葵鱼 (Amphiprion ocellaris)。受精卵的显微注射用于证明我们的 CRISPR/Cas9 方法在两个不同靶位点的成功应用:与视觉有关的视紫红质样 2B 视蛋白编码基因 (RH2B) 和与黑色素生成的酪氨酸酶生成基因 (tyr)。对眼斑海马胚胎中测序的靶基因区域进行分析表明,注射胚胎的吸收率高达 73.3%。进一步分析亚克隆的突变基因序列并结合扩增子散弹枪测序表明,我们的方法在 F0 眼斑海马胚胎中产生双等位基因突变的效率为 75% 到 100%。此外,我们清楚地显示了 tyr 突变胚胎的功能丧失,其表现出典型的低黑色素表型。该方案旨在作为进一步探索 CRISPR/Cas9 在眼斑海马中潜在应用的有用起点。眼斑鱼,作为研究小丑鱼和其他珊瑚鱼基因功能的平台。
AAV-RPGR 基因疗法挽救人类视网膜类器官模型中 RPGR 相关 X 连锁视网膜色素变性的视蛋白错误定位
摘要:视网膜色素变性 GTPase 调节剂 (RPGR) 基因内的变异是 X 连锁视网膜色素变性 (XLRP) 的主要原因,XLRP 是一种常见且严重的遗传性视网膜疾病。XLRP 的特征是光感受器的逐渐退化和丧失,导致视力丧失,并最终导致双侧失明。不幸的是,目前尚无针对 RPGR 相关 XLRP 的有效批准治疗方法。我们试图使用临床相关构建体研究 RPGR ORF15 基因补充在人类 RPGR 缺陷型视网膜类器官 (RO) 中的有效性。使用针对 RPGR 的成熟 CRISPR/Cas9 基因编辑方法生成同源 RPGR 敲除 (KO) 诱导的多能干细胞 (IPSC)。RPGR-KO 和同源野生型 IPSC 分化为 RO,并用于测试腺相关病毒 (AAV) RPGR (AAV-RPGR) 临床载体构建体。使用 AAV-RPGR 转导 RPGR-KO RO 成功恢复了 RPGR mRNA 和蛋白质的表达,并定位到杆状和锥状感光细胞中的感光连接纤毛。载体衍生的 RPGR 显示出与 WT RO 相同的谷氨酰化水平。此外,用 AAV-RPGR 治疗可恢复 RPGR-KO RO 内的视紫红质定位,从而减少对感光外核层的错误定位。这些数据提供了对 RPGR ORF15 基因补充在人类感光细胞中的功能效力的机制见解,并支持了之前报道的在 RPGR 相关 XLRP 患者中使用该载体构建体进行的 I/II 期试验的积极结果,该载体构建体目前正在进行 III 期临床试验。
丘脑底核的频率特异性光遗传学深部脑刺激可改善帕金森病的运动行为
丘脑底核 (STN) 的深部脑刺激 (DBS) 是治疗帕金森病 (PD) 运动症状的有效方法。然而,介导症状缓解的神经元素尚不清楚。先前的研究得出结论,直接光遗传学激活 STN 神经元对于缓解帕金森病症状既不是必要的也不是充分的。然而,用于细胞特异性激活的通道视紫红质-2 (ChR2) 的动力学太慢,无法跟上有效 DBS 所需的高速率,因此 STN 神经元的激活对 DBS 治疗效果的贡献仍不清楚。我们使用超快视蛋白 (Chronos) 量化了单侧 6-羟基多巴胺 (6-OHDA) 损伤后雌性大鼠的光遗传学 STN DBS 对行为和神经元的影响。 130 pps 的光遗传 STN DBS 减少了病理性旋转并改善了前肢踏步缺陷,类似于电 DBS,而使用 ChR2 的光遗传 STN DBS 不会产生行为效应。与电 DBS 一样,光遗传 STN DBS 表现出对刺激率的强烈依赖性;高刺激率可缓解症状,而低刺激率无效。高刺激率光遗传 DBS 可增加和减少 STN、苍白球外部 (GPe) 和黑质网状部 (SNr) 中单个神经元的放电率,并破坏 STN 和 SNr 中的 b 波段振荡活动。高速率光遗传学 STN DBS 确实可以通过减少 STN 相关神经回路中的异常振荡活动来改善帕金森病运动症状,这些结果强调了视蛋白的动力学特性对光遗传学刺激的效果有很大影响。
光遗传学刺激以形态依赖的方式招募皮质神经元
单光子光遗传刺激是神经科学中的关键工具,可以实现精确的、细胞类型特异性的神经回路调节。以完全可植入的宽场刺激器阵列的形式对这种技术进行小型化,可以在长期实验中询问皮质回路,并有望增强脑机接口以恢复感觉和运动功能。然而,对于基础科学和临床应用来说,这种技术必须达到在单列级别选择性激活感觉和运动表征所需的精度。然而,研究报告称,在受刺激的皮质区域内,神经元反应不同,有时甚至相互冲突。虽然循环网络机制会导致复杂的反应,但我们在这里证明,复杂性已经从神经元形态的层面开始。通过在第 2/3 层和第 5 层锥体神经元的详细模型中模拟光遗传反应,我们考虑了不同刺激强度下的真实生理动态,包括阈值、持续和去极化阻滞反应。我们的研究结果表明,皮质表面单个刺激器位置激活的神经元的空间分布可能不均匀,并且会随着刺激强度和神经元形态的变化而变化,这可能解释了早期实验中观察到的反应异质性。我们发现,由于神经元形态,激活会从光源横向扩散到几百微米。为了提高精度,我们探索了两种策略:优先在体细胞中表达通道视紫红质,这只对第 5 层神经元有效,以及缩小刺激光束,这可以提高两层的精度。我们的结果表明,在正确的光学设置下,可以实现单列精度的刺激,并且刺激器的光学增强可能比针对体细胞的基因改造提供更显著的精度改进。
光遗传学:用光控制细胞功能
调节膜电位的工具 光遗传学最常见的用途之一是改变可兴奋细胞的膜电位。在神经元中,膜去极化会导致瞬态电信号(脉冲)的激活,这是神经元通讯的基础。相反,膜超极化会导致这些信号的抑制。控制操作这些电流的“开关”使神经科学家能够研究神经元在功能上如何相互关联以及神经元回路如何控制行为。通过外源表达改变神经元膜电位的光激活蛋白,光可以用作开关。一种方法是使用化学修饰的所谓“笼状配体”,这些配体在光刺激下变得活跃并与通过基因引入特定神经元的外源性受体结合。配体也可以通过充当光开关的光敏化合物与受体本身相连。在这两种情况下,都必须将光敏的可溶性或束缚配体注入细胞或组织,使它们对光敏感。或者,可以使用编码光敏蛋白(如视蛋白)的天然基因。这些光敏跨膜蛋白与发色团视网膜共价结合,视网膜吸收光后发生异构化(例如,从反式变为顺式构型),从而激活蛋白质。值得注意的是,视网膜化合物在大多数脊椎动物细胞中含量充足,因此无需注入外源分子。第一个利用视蛋白进行哺乳动物神经元光学控制的遗传编码系统是通过外源表达果蝇的三基因系统建立的。表达这些蛋白质的神经元对光的反应是数秒内的去极化和尖峰波。最近发现,微生物中的视蛋白(将光敏域与同一蛋白质中的离子通道或泵相结合)也可以调节神经元信号,通过在单个易于表达的蛋白质中提供更快的控制,彻底改变了该方法。这些神经元开关中的第一个使用了通道视紫红质-2 (ChR2)。当在神经元中表达并暴露于蓝光时,这种非选择性阳离子通道会立即使神经元去极化