XiaoMi-AI文件搜索系统
World File Search System抗病毒研究
疱疹是一种具有传染性的终身感染,持续的发病率和流行率持续很高,在全球范围内引起了严重的疾病。当前的疗法对主动HSV感染具有功效,但对神经元中的潜在病毒储存剂没有影响。因此,尽管治疗了疾病,但疾病仍来自潜伏期,并且感染潜力仍未受到患者的影响。 在这里,使用两种经典疱疹在体内潜伏/重新激活动物模型中使用两种经典疱疹的慢性神经元HSV感染的解旋酶 - 酶抑制剂(HPI)IM-250的功效(阴道内豚鼠HSV-2感染模型和Ocular HSV-1感染模型)的功效。 在潜伏期沉默中,对感染的动物进行了4-7个循环的感染动物,随后分析了长达6个月的复发。 与常见的经验相反,我们的研究表明,潜在储层确实可以通过抗病毒疗法来改变潜在病毒储存剂,从而可以通过先前的IM-250治疗可显着降低重新激活频率。 我们提供的证据表明,HSV潜伏期期间的抗病毒治疗可以减少潜在储层的未来重新激活,支持抗病毒领域的概念转变,并重新构架潜在神经元HSV感染的治疗方案。因此,尽管治疗了疾病,但疾病仍来自潜伏期,并且感染潜力仍未受到患者的影响。在这里,使用两种经典疱疹在体内潜伏/重新激活动物模型中使用两种经典疱疹的慢性神经元HSV感染的解旋酶 - 酶抑制剂(HPI)IM-250的功效(阴道内豚鼠HSV-2感染模型和Ocular HSV-1感染模型)的功效。在潜伏期沉默中,对感染的动物进行了4-7个循环的感染动物,随后分析了长达6个月的复发。与常见的经验相反,我们的研究表明,潜在储层确实可以通过抗病毒疗法来改变潜在病毒储存剂,从而可以通过先前的IM-250治疗可显着降低重新激活频率。我们提供的证据表明,HSV潜伏期期间的抗病毒治疗可以减少潜在储层的未来重新激活,支持抗病毒领域的概念转变,并重新构架潜在神经元HSV感染的治疗方案。
对选定的有机硫化合物作为潜在
摘要:近年来,从“一种分子、一个靶点、一种疾病”到“多靶点小分子”的新兴范式转变为药物发现开辟了一条巧妙的道路。这一想法已被用于研究针对前所未有的 COVID-19 大流行的有效药物分子,该大流行已成为目前最大的全球健康危机。从临床试验中的药物中认识到有机硫化合物对抗 SARS-CoV-2 的重要性,我们选择了一类对 SARS-CoV 有效的有机硫化合物,并研究了其与 SARS-CoV-2 的多种蛋白质的相互作用。一种化合物对病毒的五种蛋白质(结构和非结构)表现出抑制作用,即主要蛋白酶、木瓜蛋白酶样蛋白酶、刺突蛋白、解旋酶和 RNA 依赖性 RNA 聚合酶。因此,这种化合物成为治疗这种恶性疾病的潜在候选药物。这项工作中进行的药代动力学、ADMET 特性和靶标预测研究进一步激发了该化合物的多功能性,并敦促未来对 SARS-CoV-2 进行体外和体内分析。
DDMDE消除了DNA引导的DNA靶向质粒侵袭
水平基因转移是细菌进化的关键驱动力,但它也通过引入侵入性的移动遗传元素给细菌带来了严重的风险。为了应对这些威胁,细菌开发了各种防御系统,包括原核生物Argonautes(Pago)和DNA防御模块DDMDE系统。通过生化分析,结构测定和体内质粒清除分析,我们阐明了DDMDE的组装和激活机制,从而消除了小型多拷贝质粒。我们证明了一种类似pago的蛋白DDME充当催化性,DNA引导,靶向DNA靶向防御模块。在存在引导DNA的情况下,DDME靶向质粒并募集二聚体DDMD,其中包含核酸酶和解旋酶结构域。与DNA底物结合后,DDMD从自身抑制的二聚体转变为活性单体,然后沿着并裂解质粒。一起,我们的发现揭示了DDMDE介导的质粒清除的复杂机制,从而为针对质粒入侵的细菌防御系统提供了基本见解。
新型抗危机辅助CRISPR生物传感器,用于独家检测单链DNA(ssDNA)
摘要:核酸分析在疾病诊断和治疗中起重要作用。CRISPR技术的发现为检测核酸的检测提供了新颖而多功能的方法。但是,使用最广泛的CRISPR-CAS12A检测平台缺乏将单链DNA(ssDNA)与双链DNA(DSDNA)区分开的能力。为了克服这一局限性,我们首先采用了抗Crispr蛋白(ACRVA1)来开发一种新型的CRISPR生物传感器,以专门检测ssDNA。在这种传感策略中,ACRVA1切割CRISPR指南RNA(CRRNA)抑制CRISPR-CAS12A系统的裂解活性。只有ssDNA具有募集裂解的crRNA片段以恢复CRISPR-CAS12生物传感器的检测能力,但DSDNA无法实现这一目标。通过测量CRISPR-CAS12A生物传感器的回收裂解活性,我们开发的ACRVA1辅助CRISPR生物传感器能够将ssDNA与dsDNA区分开,为检测SSDNA的检测提供了一种简单可靠的方法。此外,我们证明了我们开发的ACRVA1辅助CRISPR生物传感器,以监测解旋酶的酶促活性并筛选其抑制剂。关键字:基于CRISPR的生物传感器,CAS12A(CPF1)核酸酶,抗Crispr蛋白,ACRVA1,单链DNA(SSDNA)
连续靶向策略中断胶质母细胞瘤中Akt驱动的亚克隆介导的进展
摘要的最新发现表明,翻译伸长率会影响mRNA稳定性。与mRNA衰变和翻译速度之间有关这种联系的因素之一是酵母死盒解旋酶DHH1P。在这里,我们证明了DHH1P的人类直系同源物DDX6触发了人类细胞中未效率低下的mRNA的依赖性衰减。ddx6通过其reca2域中的phe-aspphe(FDF)基序与核糖体相互作用。此外,ddx6需要reca2-介导的相互作用和ATPase活性才能使降低效率低下的mRNA。使用核糖体分析和RNA测序,我们确定了以DDX6依赖性方式调节的两类内源mRNA。确定的靶标在稳态水平上进行翻译调节或调节,并且要么表现出较差的总体翻译或局部降低的核糖体易位速率的特征。将确定的序列延伸到报告基因mRNA中,导致报告基因mRNA的翻译和DDX6依赖性降解。总而言之,这些结果将DDX6识别为mRNA翻译的关键调节剂,并由缓慢的核糖体运动触发,并洞悉DDX6降低了效率低下的mRNA的机制。
和IV-A3介导的CRISPR干扰
CRISPR-Cas 介导的 DNA 干扰通常依赖于外来遗传物质的序列特异性结合和核酸降解。IV-A 型 CRISPR-Cas 系统与这种一般机制不同,它使用不依赖核酸酶的干扰途径来抑制基因表达,以进行基因调控和质粒竞争。为了了解 IV-A 型系统相关的效应复合物如何实现这种干扰,我们确定了两种进化上不同的 IV-A 型复合物(IV-A1 型和 IV-A3 型)的低温电子显微镜结构,它们在存在和不存在 IV-A 型特征 DinG 效应解旋酶的情况下与同源 DNA 靶标结合。这些结构揭示了效应复合物如何识别原间隔区相邻基序和靶链 DNA 以形成 R 环结构。此外,我们揭示了 IV-A1 型和 IV-A3 型在 DNA 相互作用和允许反式募集 DinG 的结构基序方面的差异。我们的研究提供了 IV-A 型介导的 DNA 干扰的详细视图,并为设计基于 IV-A 型的基因组编辑工具提供了结构基础。
g4access识别G Quadruplexes及其与开放的染色质和印迹控制区域的关联
后唑启动子富集于次级DNA结构形成基序中,例如G-四链体(G4S)。在这里,我们描述了“ G4Access”,这是一种通过核酸酶消化与开放染色质相关的分离和序列G4的方法。g4Access是抗体和交联的非依赖性和富集的计算预测G4S(PG4S),其中大多数在体外得到了证实。使用人和小鼠细胞中的G4ACCESS,我们鉴定出与核小体排除和启动子转录相关的细胞类型的G4富集。G4ACCESS允许测量G4配体处理后G4曲目使用的变化,HDAC和G4解旋酶抑制剂。将G4ACCESS应用于来自相互杂交小鼠交叉的细胞表明G4在控制活动印迹区域中的作用。一致地,我们还观察到G4ACCESS峰是未甲基化的,而PG4S的甲基化与DNA上的核小体重新定位相关。总体而言,我们的研究为研究细胞动力学的G4提供了一种新工具,并突出了它们与开放染色质,转录及其对DNA甲基化的拮抗作用的关联。
PICH 通过其 DNA 转位酶和 SUMO 相互作用活动影响纺锤体组装检查点
抑制或稳定有丝分裂中的 SUMO 化都会导致染色体分离缺陷,这表明蛋白质的动态有丝分裂 SUMO 化对于维持基因组的完整性至关重要。Polo 样激酶 1 - 相互作用检查点解旋酶 (PICH) 是一种有丝分裂染色质重塑酶,它通过三个 SUMO 相互作用基序 (SIM) 与 SUMO 化的染色体蛋白相互作用,以控制它们与染色体的结合。使用条件性 PICH 耗竭/PICH 替换的细胞系,我们发现有丝分裂缺陷与 PICH 对 SUMO 化染色体蛋白的功能受损有关。PICH 的重塑活性或 SIM 缺陷会延迟有丝分裂进程,这是由纺锤体组装检查点 (SAC) 激活引起的,这由着丝粒处 Mad1 焦点的持续时间延长所表明。通过对染色体 SUMO 化蛋白(其丰度受 PICH 活性控制)进行蛋白质组学分析,确定了可解释 SAC 激活表型的候选蛋白。在已确定的候选蛋白中,PICH 缺失时 Bub1 着丝粒丰度会增加。我们的研究结果证明了 PICH 和 SAC 之间的新关系,其中 PICH 直接或间接影响着丝粒上的 Bub1 关联,并影响 SAC 活性以控制有丝分裂。
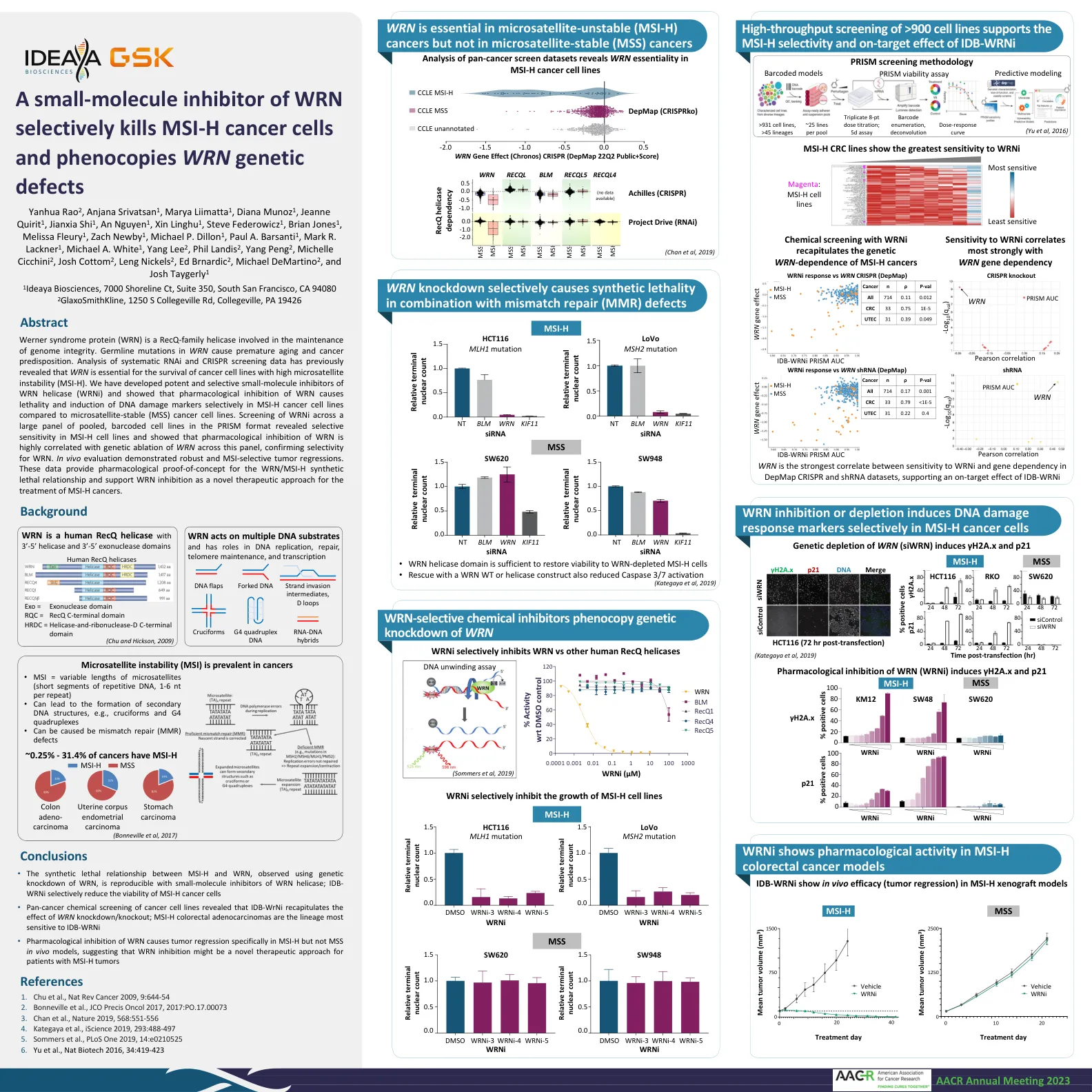
b i o s c i e e n c s wrn的小分子抑制剂有选择地杀死MSI-H癌细胞和近代WRN遗传缺陷
Werner综合征蛋白(WRN)是一种参与基因组完整性维持的RECQ家庭解旋酶。WRN中的种系突变会导致过早衰老和癌症易感性。对系统的RNAi和CRISPR筛选数据的分析先前表明,WRN对于具有较高的微卫星不稳定性(MSI-H)的癌细胞系生存至关重要。我们已经开发了有效的和选择性的小分子抑制剂(WRNI),并表明与微磷灰石稳定(MSS)癌细胞系相比,在MSI-H癌细胞系中,对WRN的药理抑制作用会导致致死性和诱导DNA损伤标志物。筛选WRNI在棱镜形式的大量合并的,条形码的细胞系中揭示了MSI-H细胞系中的选择性灵敏度,并表明WRN的药理学抑制与该面板中WRN的遗传消融高度相关,确认了WRN的选择性。体内评估表明稳健和MSI选择性肿瘤回归。这些数据为WRN/MSI-H合成致死关系和支持WRN抑制作用提供了药理概念概念,作为一种用于治疗MSI-H癌症的新型治疗方法。
通过高通量逆对接识别抗 SARS-CoV-2 的再利用药物的靶点
摘要 筛选已批准的药物以检测其对抗新型病原体的活性可能是全球应对流行病的快速反应策略的重要组成部分。这种高通量重新利用筛选已经确定了几种具有对抗 SARS-CoV-2 潜力的现有药物。然而,要将这些热门药物开发为专门针对这种病原体的药物,需要明确识别它们相应的靶标,而高通量筛选通常无法揭示这一点。我们在此介绍了一种新的计算逆对接协议,该协议使用全原子蛋白质结构和对接方法的组合对几种现有药物的靶标进行排序,最近的多个高通量筛选检测到了这些药物的抗 SARS-CoV-2 活性。我们用已知的药物-靶标对(包括非抗病毒和抗病毒化合物)证明了该方法的有效性。我们对 152 种可能适合重新利用的不同药物进行了逆对接程序。最常见的优先靶标是人类酶 TMPRSS2 和 PIKfyve,其次是病毒酶解旋酶和 PLpro。所有选择 TMPRSS2 的化合物都是已知的丝氨酸蛋白酶抑制剂,而那些选择 PIKfyve 的化合物都是已知的酪氨酸激酶抑制剂。对对接姿势的详细结构分析揭示了这些选择产生的原因,并可能有助于更合理地设计针对这些靶标的新药。